Aminosavak
Az aminosavak (más néven amino-karbonsavak) olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul.
Az α-aminosavak kiemelkedő jelentőségűek az élővilág számára, mivel a fehérjemolekulák (proteinek) építőkövei. (Az α-aminosavak közös szerkezeti jellemvonása, hogy molekuláikban egy aminocsoport és egy karboxilcsoport kapcsolódik ugyanahhoz a szénatomhoz.)
Tartalomjegyzék
- 1 Bevezetés
- 2 Története
- 3 Fehérjeépítő aminosavak
- 4 Az aminosavak kémiai előállítása
- 5 Az aminosavak ikerionos szerkezete
- 6 Optikai aktivitás
- 7 Kémiai tulajdonságok
- 8 Esszenciális aminosavak
- 9 Az aminosavak víz-ammónia "szimmetriája"
- 10 Jegyzetek
- 11 Források
- 12 További információk
- 13 Kapcsolódó szócikkek
Bevezetés[szerkesztés]
Az aminocsoportnak a karboxilcsoporthoz viszonyított helyzete alapján α-, β-, γ- stb. aminosavakról beszélünk. A fehérjék kizárólag α-aminosavakból épülnek fel.[1] A többi biológiailag általában jelentéktelen. Az egyetlen élettani jelentőséggel bíró β-aminosav a β-alanin, ennek származékai a pantoténsav és a koenzim A. Lényeges még az agy anyagcseréjének egyik eleme, a γ-aminovajsav (GABA), valamint a vitamin hatású p-amino-benzoesav.
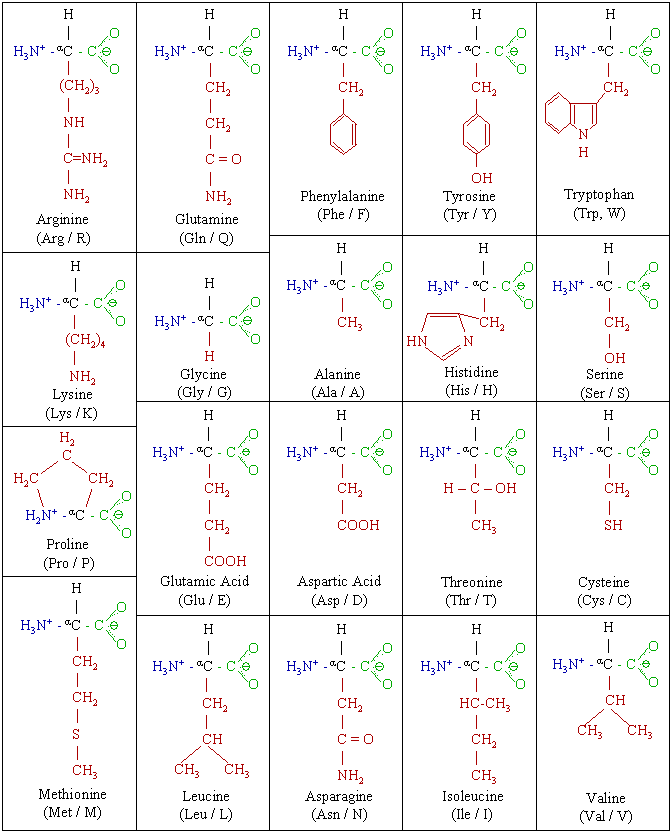
Az élő szervezetekben 22 fehérjeépítő aminosav található. Ezek kapcsolódási sorrendje az aminosav szekvencia, a fehérjék elsődleges szerkezete.
A szervezet fehérjéinek és egyéb nitrogéntartalmú alkotórészeinek felépítéséhez, és ezek újraképzéséhez szükséges aminosavakat a táplálék fehérjéi adják. A fehérjeszükséglet tehát aminosav szükségletet jelent. Az emberi szervezetben 14-16% a fehérje-, és hozzávetőlegesen 0,1% a szabad aminosavtartalom.
Története[szerkesztés]
Az első aminosavakat a 19. század elején fedezték fel. 1806-ban Louis-Nicolas Vauquelin és Pierre Jean Robiquet izoláltak egy komponens spárgából (Asparagus officinalis), amit a növény után aszparaginsavnak neveztek el. Ez volt az első aminosav, amit felfedeztek. A másik aminosav, amit a 19. század legelején fedeztek fel a cisztin (1810-ben), de monomerjét, a ciszteint csak sokkal később, 1884-ben fedezték fel. A glicint és a leucint kicsit később, 1820-ban fedezték fel. Emil Fischer és Franz Hofmeister vetette fel, hogy a proteinek amino- és karboxilcsoport összekapcsolódásával létrejövő szálszerkezetek, amit Fischer peptidnek nevezett el.
Fehérjeépítő aminosavak[szerkesztés]
| Röv. | Teljes név | Oldallánc típusa | Tömeg | pI | pK1 (α-COOH) |
pK2 (α-+NH3) |
pKr (R) | |
|---|---|---|---|---|---|---|---|---|
| A | Ala | Alanin | hidrofób | 89,09 | 6,11 | 2,35 | 9,87 | |
| C | Cys | Cisztein | hidrofób (Nagano, 1999) | 121,16 | 5,05 | 1,92 | 10,70 | 8,37 |
| D | Asp | Aszparaginsav | savas | 133,10 | 2,85 | 1,99 | 9,90 | 3,90 |
| E | Glu | Glutaminsav | savas | 147,13 | 3,15 | 2,10 | 9,47 | 4,07 |
| F | Phe | Fenil-alanin | hidrofób | 165,19 | 5,49 | 2,20 | 9,31 | |
| G | Gly | Glicin | hidrofil | 75,07 | 6,06 | 2,35 | 9,78 | |
| H | His | Hisztidin | bázikus | 155,16 | 7,60 | 1,80 | 9,33 | 6,04 |
| I | Ile | Izoleucin | hidrofób | 131,17 | 6,05 | 2,32 | 9,76 | |
| K | Lys | Lizin | bázikus | 146,19 | 9,60 | 2,16 | 9,06 | 10,54 |
| L | Leu | Leucin | hidrofób | 131,17 | 6,01 | 2,33 | 9,74 | |
| M | Met | Metionin | hidrofób | 149,21 | 5,74 | 2,13 | 9,28 | |
| N | Asn | Aszparagin | hidrofil | 132,12 | 5,41 | 2,14 | 8,72 | |
| P | Pro | Prolin | hidrofób | 115,13 | 6,30 | 1,95 | 10,64 | |
| Q | Gln | Glutamin | hidrofil | 146,15 | 5,65 | 2,17 | 9,13 | |
| R | Arg | Arginin | bázikus | 174,20 | 10,76 | 1,82 | 8,99 | 12,48 |
| S | Ser | Szerin | hidrofil | 105,09 | 5,68 | 2,19 | 9,21 | |
| T | Thr | Treonin | hidrofil | 119,12 | 5,60 | 2,09 | 9,10 | |
| V | Val | Valin | hidrofób | 117,15 | 6,00 | 2,39 | 9,74 | |
| W | Trp | Triptofán | hidrofób | 204,23 | 5,89 | 2,46 | 9,41 | |
| Y | Tyr | Tirozin | hidrofób | 181,19 | 5,64 | 2,20 | 9,21 | 10,46 |
| U | Sec | Szelenocisztein | hidrofób | 168,05 | ||||
| O | Pyl | Pirrolizin | 255,31 | |||||
Az aminosavak kémiai előállítása[szerkesztés]
Számos módszer ismert az aminosavak szintézisére. A legrégebbi módszer a karbonsavak α-szénjének brómozása. A következő lépésben, az alkil-bromid nukleofill szubsztitúció során ammonia aminosavvá alakítja. Egy másik lehetséges mód a Strecker-féle aminosav szintézis, amely során aldehidet reagáltatunk kálium-cianiddal és ammóniával, így intermedierként α-amino nitril képződik. A nitril savas hidrolízisével α-aminosav képződik. Aldehid helyett ketonokat is használhatunk, de ebben az esetben α,α-diszubsztituált aminosav származékot kapunk. A klasszikus szintézis az aminosavak racém elegyét eredményezi, de számos alternativ módszerrel enantioszelektív előállítás is lehetséges.
Az aminosavak ikerionos szerkezete[szerkesztés]
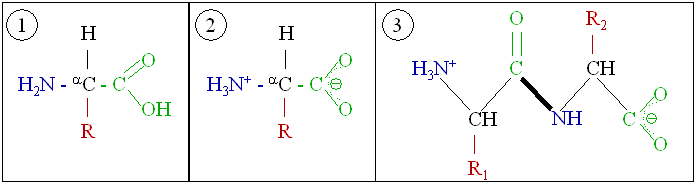
Az aminosavak ikerionos szerkezetűek, azaz nem egyszerű aminocsoportot és karboxilcsoportot tartalmaznak (1. kép), hanem pozitív töltésű ammónium- és negatív töltésű karboxilátcsoportot, a savas karboxilcsoport és a bázikus aminocsoport kölcsönhatása következtében (2. kép). Tehát ikerionok szilárd halmazállapotban, és vizes oldatban egyaránt. Ezzel magyarázható az, hogy szilárd anyagok és nagyon magas az olvadáspontjuk. Sőt, meg sem olvadnak, hanem az olvadási hőmérsékleten bomlanak. Ugyanakkor jól oldódnak vízben (poláris oldószer), de nem oldódnak apoláris szerves oldószerekben.
Akárcsak az aminosavak, a peptidek és fehérjeláncok is ikerionos szerkezetűek (3. kép).
Szerkezeti képletek[szerkesztés]
Nemzetközi megállapodás alapján az aminosavakat nevük hárombetűs rövidítésével, bonyolultabb esetekben az ábécé nagybetűivel jelöljük.
Interaktív 3D-molekulamodellek:
| Arg | Gln | Phe | Tyr | Trp |
| Lys | Gly | Ala | His | Ser |
| Pro | Glu | Asp | Thr | Cys |
| Met | Leu | Asn | Ile | Val |
Optikai aktivitás[szerkesztés]
A legtöbb α-aminosav optikailag aktív, két tükörképi izomerje (enantiomerje) lehetséges.
A fehérjeépítő α-aminosavak a jobbra forgató, de L-sorozatbeli tejsavval azonos térszerkezetűek, tehát az L-sorozatba tartoznak.
Kivétel a glicin, amely optikailag nem aktív.
Kémiai tulajdonságok[szerkesztés]
Az aminosavak ún. amfoter tulajdonságú vegyületek, vagyis amfolitok: savakkal szemben gyenge bázisként, bázisokkal (lúgokkal) szemben gyenge savként viselkednek. Tehát vizes oldatban egyaránt semlegesítik az erős savak illetve erős bázisok kis mennyiségét, illetve lényegesen tompítják azokat. Az ilyen anyagokat puffernek nevezzük. (A vasúti kocsik ütközőjét hívják így németül.) Ennek óriási szerepe van az élő szervezetekben, mivel azok mind vizes oldatok. Kivédik azokban az elsavasodást, illetve lúgosodást.
Az aminosavakra egyaránt jellemzőek a karbonsavak és az aminok reakciói.
Elektrokémiai tulajdonságok[szerkesztés]
Vizes oldatban, egy meghatározott pH értéken, az illető aminosav izoelektromos pontján (PI), egyenlő mértékben ionizált az aminosav mindkét csoportja: kifelé semleges, elektromos erőtérben ionmigrációt nem mutat. A legtöbb aminosav izoelektromos pontja közelítőleg semleges pH-nál van. A savas oldalláncú aminosavak izoelektromos pontja savas pH-nál van, a bázikus oldalláncúaké pedig bázikus pH-nál.
A karboxilcsoport disszociációs állandója szám szerint megegyezik annak az oldatnak a hidrogénion-koncentrációjával (), amelynél az ionizálatlan és az ionizált karboxilcsoportok száma egyenlő: = (), illetve = ( ahol a = -log, és p = -log).
Hasonlóképpen egy p-érték rendelhető a bázikus aminocsoport ionizációjára jellemző és a értékekhez.
Az izoelektromos pont hidrogénkitevőjét (PI) a következő képlettel számíthatjuk ki: PI = ( + )/2
(Ezek az értékek megtalálhatóak a "Fehérjeépítő aminosavak" táblázatban.)
Peptidképződés[szerkesztés]
Az aminosavak peptidkötéssel kapcsolódnak egymáshoz, vízkilépés közben.
Két aminosavból dipeptid, háromból tripeptid, sokból polipeptidlánc képződik. A fehérjemolekulák tehát sok aminosavrészből felépülő polipeptidláncok.
Két különböző aminosavból két különböző dipeptid épülhet fel aszerint, hogy melyik aminosavrész N-terminális és melyik C-terminális:
A glicil-alanin ( H-Gly-Ala-OH ) képlete: (bal oldali molekulamodellek)
Az alanil-glicin (H-Ala-Gly-OH) képlete: (jobb oldali molekulamodellek)
A két dipeptid - a glicil-alanin és az alanil-glicin - konstitúciós izomerje egymásnak; ezek különböző sajátságú anyagok.
Három különböző aminosavból már hat különböző szerkezetű tripeptid vezethető le. Következésképpen az egymáshoz kapcsolódó aminosavak számának növekedésével rohamosan nő a sorrendi lehetőségek száma. A kombinatorika szabályai szerint n számú különböző aminosav n! (1,2,3…,n)-féle sorrendben kapcsolódhat egymáshoz. Így tíz különböző aminosavból felépülő dekapeptid esetében már 3 628 800 szerkezeti lehetőséget jelent, pedig hol van az még a fehérjeláncok méretétől!
Ezzel magyarázható az élő szervezetekben előforduló fehérjék rendkívüli változatossága. A fehérjeláncokat az egymáshoz kapcsolódó aminosavak milyensége, száma és sorrendje jellemzi.
Hidrolízis[szerkesztés]
A fehérjék savas hidrolízisének eredményeként aminosavak (tömény sósavval főzve azok sósavas sói) keletkeznek.
Esszenciális aminosavak[szerkesztés]
Alapvető fontosságú (esszenciális) aminosavaknak nevezzük azokat az aminosavakat, amelyeket az emberi vagy állati szervezet nem, vagy csak elégtelen mennyiségben képes előállítani.
Az emberi szervezet számára 9 aminosav esszenciális (ábécé-sorrendben):
A különböző állatfajok számára más-más aminosavak lehetnek esszenciálisak.
Elsőrendű fehérjék[szerkesztés]
A fehérjék biológiai értékét esszenciális aminosav tartalmuk határozza meg. Az elsőrendű, (komplett) fehérjék valamennyi esszenciális aminosavat a megfelelő mennyiségben, arányban tartalmazzák, ezért egyedüli fehérjeforrásként is elegendőek. Ebbe a csoportba az állati eredetű fehérjék tartoznak, mint a tojás, tej, hal, vagy a húsfélék.
Másodrendű fehérjék[szerkesztés]
A másodrendű (inkomplett) fehérjék egyes esszenciális aminosavakban hiányosak, ezért önmagukban elégtelen fehérjeforrások. Azonban a komplett, vagy egy másik inkomplett fehérjével kiegészítve teljes értékűvé tehetők. A másodrendű fehérjék csoportját zömében a növényi fehérjék alkotják.
Fehérjeszükséglet[szerkesztés]
Abszolút fehérjeminimum[szerkesztés]
Az emberi szervezet megfelelő energiabevitel mellett fehérjementes étrendben is használ fel fehérjét. Ez az endogén fehérjeveszteség a vizeletben, székletben, a verejtékben, és más váladékokban (köröm, haj, hámló bőr) lévő nitrogén meghatározásával ki is mutatható. Pl: Egy 70 kg-os férfi endogén fehérje-vesztesége 24 g/nap. Ezt abszolút fehérjeminimumnak is nevezik.
Élettani fehérjeminimum[szerkesztés]
Az a legkisebb fehérjebevitel, amellyel a szervezet nitrogénegyensúlya éppen elérhető. Vagyis a bevitt fehérje nitrogéntartalma egyenlő a vizelettel, széklettel, verejtékkel, és egyéb módokon ürített nitrogén mennyiségével. Egy egészséges, 70 kg-os, fiatal férfi fehérjeminimuma 42 g/nap.
Ajánlott fehérjebevitel[szerkesztés]
Gyermekek fehérjeszükséglete A bevitt fehérjének fedeznie kell a növekedéshez szükséges mennyiséget, a növekedés viszont nem egyenletes, ezért a fehérjebevitelt úgy kell megállapítani, hogy mindenkor elegendő fehérje álljon rendelkezésre. Ez a mennyiség az életkor függvényében 32-75g/nap.
Felnőttek fehérjeszükséglete Vegyes táplálkozás mellett figyelembe kell venni a fehérjék emészthetőségét, valamint az aminosav-összetételt jelző biológiai értékeket, a hazai táplálkozási szokásokat, a fehérjék kölcsönös kiegészítő (komplettáló) hatását. Így a testtömegre számított fehérjebevitel, 1 g/ttkg javasolt aktívan nem sportoló személyeknek. Sportolóknak ennél többre is szükségük lehet (1.5-2g/ttkg).
Terhesek fehérjeszükséglete Vegyes táplálkozás mellett, a terhesség teljes időtartama alatt, 10 g/nappal több bevitelre van szükség, mint a terhességet megelőzően.
Szoptatás alatti fehérjeszükséglet Mivel az anyatej átlagos fehérjetartalma 1,2-1,3 g/100 g, ezért a 100 g elválasztott tejre 2,4 g fehérjét kell bevinni. Vagyis az első 6 hónapban napi 20 g, míg a hetedik hónaptól napi 15 g többlet fehérjebevitel ajánlott.
Az idősek fehérjeszükséglete Az életkor előrehaladtával változik a testösszetétel, az élettani funkciók, a fizikai aktivitás, az elfogyasztott táplálék mennyisége, de egyben csökken a fehérjék hasznosulása is, ezért a 60 évesnél idősebbek részére 1,2-1,5 g/ttkg bevitel ajánlott.
Az aminosavak víz-ammónia "szimmetriája"[szerkesztés]
Az aminosavak molekulájában előforduló aminocsoport (-NH2) és karboxilcsoport (-COOH) érdekes lehetőséget vet föl az életformáló aminosavak keletkezésére. Ezek olyan bolygófelszínek közelében keletkezhettek, ahol mindkét oldószer, az ammónia is és a víz is fontos szerepet játszott. Ha az aminosavak közül a 20 fehérjealkotót vizsgáljuk, sorba rendezhetjük őket a vizes jelleg és az ammóniás jelleg súlya szerint. A vizes oldalt képviseli az OH gyök és a COOH gyök, míg az ammóniás oldalt az (-NH2) gyök és a HNOOH gyök. Az ábra bal oldalán az elrendezés mintáját mutatjuk be a kis hatszögekkel. Az ábra jobb oldala az élet fehérjéit alkotó aminosavak víz-ammónia "szimmetriáját" szemlélteti.
Jegyzetek[szerkesztés]
- ↑ Más szóval 2-aminosav, azaz az NH2-csoport a karboxilcsoporttal szomszédos szénatomhoz kapcsolódik.
Források[szerkesztés]
- Kajtár Márton: Változatok négy elemre / felújított, újra kiadás: Eötvös Kiadó, 2009 / eredeti: Gondolat, 1984 / Budapest
- Felszeghy Ödön, Ábrahám Sándor: A biokémia alapjai / Dacia könyvkiadó / Kolozsvár, 1976
- Bérczi Sz. Homonnay Z., Lukács B., Mörtl M., Weidinger T. (2005): Kis Atlasz a Naprendszerről (8): Űrkutatás és kémia. ELTE TTK Kozmikus Anyagokat Vizsgáló Űrkutató Csoport, Budapest (ISBN 963-00-6314-X Ö ISBN 963 86401 9 7)
- Bérczi Sz., Lukács B. (1995): Solvent Liquids on Planets. Acta Climatologica, Szeged, XXVIII-XXIX. p. 5-22. (HU ISSN 0563-0614)
- Bérczi Sz., Lukács B. (1996): The Water-Ammonia Symmetry of Amino Acids: Constraints on Paleoatmospheres. Acta Climatologica, Szeged, 30. p. 5-30. (HU ISSN 0563-0614)
További információk[szerkesztés]
- Dr. John McDougall: A Brief History of Protein: Passion, Social Bigotry, Rats, and Enlightenment (angolul)
- Magyar fordítás: Dr. John McDougall: A fehérje rövid története: Szenvedély, társadalmi bigottság és felvilágosodás
Kapcsolódó szócikkek[szerkesztés]
|