Víz
| Víz | |

| |
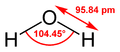 A vízmolekula szerkezete |
 A vízmolekula 3D modellje |
| IUPAC-név | víz oxidán[1] |
| Más nevek | dihidrogén-monoxid, hidrogén-hidroxid, aqua (latin) |
| Kémiai azonosítók | |
| CAS-szám | 7732-18-5 |
| RTECS szám | ZC0110000 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | H2O |
| Moláris tömeg | 18,01528(33) g/mol |
| Megjelenés | színtelen, szagtalan |
| Sűrűség | 0,99701 g/cm³[2] |
| Olvadáspont | 0 °C (273,15 K) (32 °F)[2] |
| Forráspont | 100 °C (373,15 K) (212 °F)[2] |
| Savasság (pKa) | 15,74 |
| Lúgosság (pKb) | 15,74 |
| Törésmutató (nD) | 1,3330 |
| Viszkozitás | 0,8903 cP[2] |
| Kristályszerkezet | |
| Kristályszerkezet | Hexagonális lásd jég |
| Molekulaforma | V-alakú |
| Dipólusmomentum | 1,85 D |
| Termokémia | |
| Std. képződési entalpia ΔfH |
−285,85 kJ/mol[2] |
| Hőkapacitás, C | 75,28 J/mol·K |
| Veszélyek | |
| EU osztályozás | nincsenek veszélyességi szimbólumok[3] |
| Főbb veszélyek | Nincs |
| NFPA 704 | |
| R mondatok | nincs[3] |
| S mondatok | nincs[3] |
| LD50 | >90 ml/kg (patkány, szájon át)[4] |
| Rokon vegyületek | |
| Rokon vegyületek | nehézvíz |
| Az infoboxban SI mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |

A víz, vagyis a dihidrogén-monoxid (latinul: aqua) a hidrogén és az oxigén vegyülete, kémiai képlete H2O. Színtelen, szagtalan, íztelen, folyékony kémiai anyag, melynek mikroorganizmusoktól mentes állapotban olvadáspontja 0 °C, forráspontja 100 °C 101,3 kPa nyomáson. Egészen -48 Celsius-fokig túlhűthető.[5]
A „víz” megnevezés általában a szobahőmérsékleten folyékony állapotra vonatkozik, szilárd halmazállapotban jégnek, légnemű halmazállapotban gőznek nevezik. Dipólusmolekulák alkotják. A víz egy amfoter vegyület, ami azt jelenti, hogy viselkedhet savként és bázisként is.
A vendéglátásban a vezetékes és palackozott ivóvízzel, a forrásvízzel, a szikvízzel, az ásványi anyaggal dúsított ivóvízzel, az ízesített vízzel, a természetes ásványvízzel és a gyógyvízzel találkozhatunk. Napjainkban az ivóvizet már előállítják, kitermelik, és csővezetékeken keresztül juttatják el a felhasználókig. Régen főleg kútból/gémeskútból húzták fel a vizet, bár még most is vannak ilyen kutak.
Tartalomjegyzék
Az ivóvizek fajtái[szerkesztés]
- Vezetékes ivóvíz
- Palackozott ivóvíz
- Forrásvíz
- Szikvíz
- Ásványi anyaggal dúsított ivóvíz
- Ízesített víz
- Természetes ásványvíz
Előfordulása a Földön[szerkesztés]
- A víz a Föld felületén megtalálható egyik leggyakoribb anyag, a földi élet alapja.
- A Föld felületének 71%-át víz borítja, ennek kb. 2,5%-a édesvíz, a többi sós víz, melyek a tengerekben, illetve óceánokban helyezkednek el. Az édesvízkészlet gleccserek és állandó hótakaró formájában található részét nem számítva az édesvíz 98%-a felszín alatti víz, ezért különösen fontos a felszín alatti vizek védelme. Magyarország ivóvízellátásának több mint 95%-a felszín alatti vizeken alapszik. Kanada rendelkezik a legnagyobb édesvíz-tartalékokkal, a források 25%-ával.
Drasztikusan csökken a Föld ivóvízkészlete.[6] Korunknak egyik nagy problémája az ivóvízhiány. 2006-ban a mezőgazdaság felelős a globális vízfogyasztás mintegy 80%-áért.[7]
Geológiai értelemben a víz egyszerre két csoportba tartozik:
Ásványként az oxidásványok ásványosztályba és annak 1. alosztályába (egyszerű oxidok közé) tartozik, és a SiO2-hoz hasonló tetraéderes elemi cellái hatszöges kristályrendszerű (hexagonális) kristálykifejlődést eredményeznek. Általános megjelenési formája a hatszöges oszlop lenne, ennek azonban leggyakoribb és legismertebb a kezdeti fázisa a hópihe, a hatszöges oszlop metszete.
Kőzetként monomineralikus, a hidrogén-oxid ásványból álló üledékes kőzet. Ezt nem befolyásolja a folyékony halmazállapot, ahogy a higany is lehet ásványos terméselem, sőt a földgáz is kőzetfajta.
Az ivóvíz[szerkesztés]
A közfogyasztású ivóvizek vizsgálatát és ellenőrzését Magyarországon az Országos Közegészségügyi Intézet, valamint a helyi Állami Népegészségügyi és Tisztiorvosi Szolgálat (ÁNTSZ) végzik. [1]
A közegészségügyi előírások a főzésre, mosogatásra, testi tisztálkodásra szolgáló víztől ugyanazokat a tulajdonságokat követelik meg, mint az ivóvíztől. Az előírások szerint az alábbi tulajdonságokkal kell rendelkeznie az ivóvíznek:
- Színtelen, átlátszó:
- a vas-oxid-hidrát vörösessé, az algák zöldessé, a tőzeges talaj sárgássá festi, míg az algák, baktériumok, agyag és homok zavarossá tehetik a vizet. A festékanyagok olyan színűre színezik a vizet, amilyen színűek.
- Szagtalan:
- A kén-hidrogén, klór, klórfenolok, szerves anyagok, gyári termékek és gázok élvezhetetlenné, nagyobb mértékben az egészségre is károssá tehetik a vizet.
- Kellemes ízű:
- A tőzeges talajból származó vizek úgynevezett mocsárízzel, a magnéziumsók keserű, salétromsavas sók édes, a kloridok sós, a vas tintaízű vizet eredményeznek.
- Kellemes hőfokú legyen:
- A legjobb a 10-14 °C-os ivóvíz.
- Ne legyen sem túl lágy, sem túl kemény:
- A víz keménységét a benne oldott kalcium- és magnéziumsók adják.
- Ne tartalmazzon az egészségre ártalmas szennyező, fertőző anyagokat:
- A vizsgálólaboratóriumok ki tudják mutatni a levegőből, a talajból bekerült szennyező anyagok mennyiségét. A vegyi anyagok közül a nitrát-, de különösen a nitritszennyeződés alkalmatlanná teszi, míg a nagyobb mennyiségű fluor a fogak elszíneződését, esetleg fogszuvasodást is okoznak. A vas- és mangánszennyeződéseket levegőztetéssel, homokrétegen és aktívszénen való átszűréssel javítják. A jódhiánytól golyvát kaphatnak az emberek. Előfordulhat még a fekáliával való fertőzés, ilyen esetekben a kólibaktérium okozta hasmenéssel kell számolnunk, ennek megszüntetésére felforralják, ultraibolya fénnyel besugározzák, vagy ózonizálják, klórozzák, vagy ezüst elektrokatadinezésével tisztítják meg a vizet. A háztartási és ipari víztisztítás jelenleg igen elterjedt módszere még a fordított ozmózis elve alapján történő víztisztítás.
A 18. század előtti írásokban az édes (iható) vizeket jónak nevezték.
Élettani jelentősége[szerkesztés]
Biológiai jelentősége óriási, a földi élet elképzelhetetlen nélküle, a sejt- és testnedvek legnagyobb részét víz alkotja. A vér ozmózisnyomásának normál szinten tartásában is jelentős szerepe van. Ajánlott a napi legalább 1,5-2 liter folyadék elfogyasztása, ez alapvető igénye szervezetünknek. Két-három napnál tovább az orvostudomány mai állása szerint az ember nem élheti túl a vízhiányt.
A víz rendkívül fontos szerepet betöltő kémiai anyag, a Föld vízburkát alkotja, kitölti a világ óceánjait és tengereit, az ásványok és kőzetek alkotórésze, a növényi és állati szervezetek pótolhatatlan része. Nagyon fontos az iparban, a mezőgazdaságban, a háztartásokban, a laboratóriumokban stb.
A vizekben élő állatok számára nélkülözhetetlen. Az oldott oxigént lélegzik kopoltyújukkal, másrészt télen, mivel 4 °C-on a legsűrűbb, a 4 °C-os víz a vizek aljára süllyed, és ezek után nem érintkezik a hideg levegővel, ezért nem fagy meg. Így az állatok áttelelhetnek megfagyás nélkül a tavak alsó részeiben.
Az alapelemek egyike[szerkesztés]
A mitológia illetve az ókori tudomány több helyen fontos dologként hivatkozik a vízre: Az arisztotelészi négy alapelem (föld, víz, levegő, tűz) egyike.
Tulajdonságai[szerkesztés]
A víz színtelen, szagtalan, íztelen folyadék. Az ivóvíz kellemes ízét a benne oldott anyagok okozzák. A víz az egyetlen olyan anyag a Földön, amely mindhárom halmazállapotában megtalálható. A víznek +4 °C-on a legnagyobb a sűrűsége. Télen a folyóknak és tavaknak általában csak a teteje fagy be, így a jég alatt megmarad az élővilág. A jégben a vízmolekulák kristályt, vagyis molekularácsot alkotnak. A víz jó oldószer. 1 liter vízből kb. 1750 liter gőz keletkezik. Nagy hőmérséklet hatására (pl. olvadt fém) termikus bomlás következik be, azaz hidrogénre és oxigénre bomlik – ezek elegye az igen robbanékony durranógáz.
A víz sűrűsége 4 °C-on maximális, 20 °C-on 998,2 kg/m³.
A víz folyékony és szilárd halmazában is a vízmolekulák között hidrogénkötések (hidrogénhíd-kötések) jönnek létre: az egyik vízmolekula hidrogénatomja kapcsolódik a másik vízmolekula oxigénatomjának egyik nemkötő elektronpárjához. A molekulák közti hidrogénkötésben álló hidrogén és oxigén atommagok nagyobb távolságra vannak egymástól, mint a molekulán belüli kovalens kötésben álló hidrogén és oxigén atommagok. Egy vízmolekula összesen 4 másik vízmolekulához képes hidrogénkötéssel kapcsolódni. A folyékony halmazállapotú vízben nem minden hidrogénkötés jön létre, kialakulásuk és felbomlásuk folyamatos, csak részleges rendezettség alakul ki. Azonban a víz jéggé fagyásakor – azaz a molekularácsos kristályszerkezet kialakulásakor – minden hidrogénkötés létrejön, a molekulák között teljes rendezettség alakul ki, amely egyúttal rosszabb térkihasználtságot eredményez, mint amit a molekulák a folyékony vízben megvalósítanak: a molekulák a jégben távolabb helyezkednek el egymástól, nagyobb teret töltenek be, mint a vízben. Ez okozza azt, hogy a jég sűrűsége kisebb, mint a vízé, és fagyáskor a többi anyagtól eltérően a víz térfogata megnő (mintegy 9%-kal). Ezért úszik a jég a vízen.[8][9]
A víz mint oldószer[szerkesztés]
A víz molekulája poláris molekula: az oxigénatomok felé eső molekularész kissé negatív, a hidrogénatomok felé eső rész pedig kissé pozitív töltésű. Ennek köszönhető, hogy a víz sok ionvegyület, például a konyhasó (NaCl) jó oldószere.
Túlhűtött víz[szerkesztés]
A víz jéggé alakulásához apró, szilárd szennyezőanyagoknak kell a vízben lenniük, amik körül a jéggé alakulás megindulhat. Ez átlagosan -12 °C körül következik be. Az ilyen hőmérsékletű víz kisebb rázkódás vagy porszem hatására is azonnal látványosan (3–5 cm/s) kristályosodásnak indul, de nem fagy meg teljesen. A jégkristályok között marad folyékony halmazállapotú víz, ami csak -48 °C-on fagy tömör jéggé. A mindenféle szennyeződéstől mentes („szupertiszta”) vizet ugyanis -48 °C-ig is le lehet hűteni anélkül, hogy jéggé fagyna.[10] -48 °C-on azonban a víz szerkezete hirtelen jéggé alakul, melyet hangjelenség kísér. Ez a legtisztább víznél is bekövetkezik. A 0 és -48 fok közötti víz azért kezd el kristályosodni, mert a hidrogénhíd-kötések ekkor már képesek összetartani a vízmolekulákat. Elektromos töltés hatására a víz dermedéspontja megváltozik. Az egyébként szokásos -12 °C helyett, ha a felszín pozitív elektromos töltésű, akkor -7 °C lesz, míg negatív töltés esetén -18 °C-ig hűthető.[11]
A kialakult anyag tovább hűthető. -120 °C alatt a víz sűrűn folyóvá válik. -135 °C-nál üvegesen áttetsző lesz kristályszerkezet kialakulása nélkül.
A Mpemba-paradoxon[szerkesztés]

A víz különleges tulajdonsága, hogy változatos körülmények között a fagyni kitett meleg víz hamarabb fagy meg, mint mellette a hideg. A Mpemba-paradoxonra több részleges magyarázatot adtak, de a teljes megértéshez még további vizsgálatokra van szükség.[12]
A víz sűrűségmaximuma[szerkesztés]
A víz sűrűségmaximuma a fagyáspont felett van (4 Celsius-fok). A sűrűség és a hőmérséklet közötti összefüggés , de némi hiba van benne. Az összefüggés nem lineáris.
Kapcsolódó szócikkek[szerkesztés]
Jegyzetek[szerkesztés]
- ↑ Leigh, G. J. et al. 1998. Principles of chemical nomenclature: a guide to IUPAC recommendations, p. 99. Blackwell Science Ltd, UK. ISBN 0-86542-685-6
- ↑ a b c d e N. N. Greenwood, A. Earnshaw: Az elemek kémiája, 847. o. Nemzeti Tankönyvkiadó, Budapest, 1999. ISBN 963-18-9144-5
- ↑ a b c A víz (BGIA GESTIS)[halott link] (németül)
- ↑ Biztonsági adatlap (jtbaker.com). [2010. szeptember 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. október 17.)
- ↑ Archivált másolat. [2012. augusztus 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. augusztus 25.)
- ↑ Rohamosan csökkennek a természeti erőforrások Archiválva 2007. július 9-i dátummal a Wayback Machine-ben (2005. március 30.)
- ↑ Ivóvíz hiány Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben (2006. augusztus 16.)
- ↑ víz - egy "különleges" anyag elérve: 2008-03-12
- ↑ A víz (H2O). In Balázs Lórántné – J. Balázs Katalin: Kémia: Ennyit kell(ene) tudnod. Lektorálta: Mándics Dezső. Harmadik, javított kiadás. Budapest: Akkord Kiadó – Panem Kiadó. 1999. 153–155 (150–158). o. ISBN 963-545-256-X
- ↑ http://mernokbazis.hu/cikkek/a-v%C3%ADz-igazi-fagy%C3%A1spontja-%E2%80%93-m%C3%ADnusz-48-%C2%B0c Archiválva 2012. február 12-i dátummal a Wayback Machine-ben A víz igazi fagyáspontja –48 °C
- ↑ http://www.sciencenews.org/view/generic/id/56134/title/A_charge_for_freezing_water_at_different_temperatures A charge for freezing water at different temperatures
- ↑ National Geographic Magyarország cikke a Mpemba-paradoxonról
További információk[szerkesztés]
- Magyar Hidrológiai Társaság – a víz helyzete ma Magyarországon
- EU-s normák
- Kút létesítésének technológiája
- Esővízgyűjtők készítésének technológiája
- Vízpiac Magazin
- Physicists discover new quantum state of water (2011-02-04)
- Elképesztő: a világegyetem legnagyobb víztárolója egy kvazár körül[halott link]. Mno.hu.
- A 4 °C-os víz sűrűsége – YouTube videó
|





.jpg/220px-Szökőkút_(Bibione).jpg)





