Glükóz
|
|
Ez a szócikk egy középiskolai dolgozat vagy egyetemi jegyzet stílusában íródott. a Wikipédiában szokásos stílusra és formára. |
| Glükóz | |||
| |||
| |||
| IUPAC-név | 6-(hidroximetil)oxán -2,3,4,5-tetrol VAGY (2R,3R,4S,5R,6R)-6-(hidroximetil) tetrahidro-2H-pirán-2,3,4,5-tetraol | ||
| Más nevek | szőlőcukor, dextróz | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 50-99-7 (D-glükóz) 921-60-8 (L-glükóz) | ||
| PubChem | 5793 | ||
| ChemSpider | 5589 | ||
| KEGG | C00031 | ||
| MeSH | Glucose | ||
| ChEBI | 4167 | ||
| RTECS szám | LZ6600000 | ||
| ATC kód | B05CX01, V04CA02, V06DC01 | ||
| Gyógyszer szabadnév | glucose | ||
| |||
| UNII | 5SL0G7R0OK | ||
| ChEMBL | 1222250 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C6H12O6 | ||
| Moláris tömeg | 180,16 g mol−1 | ||
| Sűrűség | 1,54 g cm−3 | ||
| Olvadáspont | α-D-glükóz: 146 °C β-D-glükóz: 150 °C | ||
| Veszélyek | |||
| EU osztályozás | nincsenek veszélyességi szimbólumok[1] | ||
| R mondatok | (nincs)[1] | ||
| S mondatok | (nincs)[1] | ||
| LD50 | 25800 mg/kg (patkány, szájon át)[1] | ||
| Rokon vegyületek | |||
| Rokon vegyületek | Fruktóz Mannóz Galaktóz | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A glükóz – köznapi nevén szőlőcukor – (C6H12O6, rövidítése: Glc) egy monoszacharid, ezen belül 6 szénatomot és aldehidcsoportot tartalmazó aldohexóz. Fontossága a biológiai folyamatokban alapvető: a sejtek energia- és metabolitforrásként hasznosítják. Bioszintézise szén-dioxidból és vízből kiindulva fotonenergia felhasználásával történik a zöld növényekben a fotoszintézis során. Élő szervezetben a glükóznak csak a D enantiomerje fordul elő, melyet dextróznak neveznek. Az L-glükóz biológiailag inaktív, a sejtek nem tudják hasznosítani.
A szó a görög glykysz (γλυκύς = édes) szóból származik.[2]
A VIII. Magyar Gyógyszerkönyvben négy néven hivatalos:
| Glükóz, vízmentes | Glucosum anhydricum |
| Glükóz-szirup | Glucosum liquidum |
| Glükóz-szirup, porlasztva szárított | Glucosum liquidum dispersione desiccatum |
| Glükóz-monohidrát | Glucosum monohydricum |
Tartalomjegyzék
Szerkezet[szerkesztés]
Nyílt láncú alak[szerkesztés]
A glükóznak nyílt láncú és gyűrűs alakja is létezik. A nyílt láncú alakjának lánca hatszénatomos, elágazás nélküli lánc. Az 1-es szénatom egy aldehidcsoport (formilcsoport) része, a többi öt szénatomhoz egy-egy hidroxilcsoport kapcsolódik. A nyílt láncú alak 4 aszimmetriás szénatomot tartalmaz.
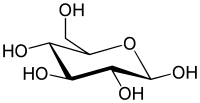
Gyűrűs alak[szerkesztés]
A glükóz gyűrűvé is záródhat. Legstabilabb a szék alakú, hattagú, piranózgyűrűs alakja. A piranózgyűrűs glükóz neve glükopiranóz. Gyűrűvé záródáskor az 5. szénatomon lévő hidroxilcsoport és a formilcsoport között intramolekuláris félacetál kötés jön létre, laktolgyűrű alakul ki. A gyűrűvé záródás következtében az eredetileg a formilcsoportot alkotó szénatom (1-es szénatom) is aszimmetriássá válik. Az ezen a szénatomon a gyűrűvé záródáskor kialakuló ún. glikozidos hidroxilcsoportnak kétféle térállása lehetséges. Éppen ezért a gyűrűs D-glükóznak kétféle anomer módosulata lehetséges: α-D-glükóz és β-D-glükóz (α-D-glükopiranóz és β-D-glükopiranóz) . Az α és a β alak átalakulhat egymásba. Az α-alak optikai forgatóképessége +112°, a β-alak optikai forgatóképessége +18,7°. A D-glükóz vizes oldatában egyensúlyi elegy alakul ki, ez körülbelül 62% β-D-glükózt, 38% α-D-glükózt és kevés nyílt láncú D-glükózt tartalmaz, az oldat forgatóképessége ekkor +52,7°. Az α módosulatban a glikozidos hidroxilcsoport a gyűrű tengelyével párhuzamos (axiális) helyzetű, a β módosulatban a tengelyre merőleges (ekvatoriális) helyzetű. A két módosulat közül a β a stabilabb.
A glükóz piranózgyűrűjének a ciklohexánszármazékokhoz hasonlóan kétféle székalkata lehetséges. A szénhidrátkémiában a kétféle székalkatú konformáció jelölése C1 illetve 1C. Az α-D glükóz és a β-D-glükóz esetében a C1 konformáció a stabilabb, mert így a hidroxilcsoportok (α-D-glükóz esetén a glikozidos hidroxilcsoportot kivéve) és a CH2OH csoport a kedvezőbb, ekvatoriális helyzetbe kerülnek. Az α-L-glükóz és a β-L-glükóz esetén azonban az 1C konformáció a kedvezőbb.
Izomerjei[szerkesztés]
Az aldohexózok nyílt láncú alakja 4 kiralitáscentrumot tartalmaz. Ezek az kiralitáscentrumok nem azonos telítettségűek. Így 24=16-féle aldohexóz lehetséges. Ezek közül 8 a D-sorozathoz, 8 az L-sorozathoz tartozik. Csak néhány található meg közülük az élő szervezetben, ezek többsége a D-módosulat. A legjelentősebbek a D-glükóz, a D-mannóz és a D-galaktóz. Ha az aldohexóz hattagú laktolgyűrűvé (piranózgyűrűvé) záródik, új kiralitáscentrum alakul ki, a glikozidos hidroxilcsoportnak kétféle térállása lehetséges. Tehát 25=32 sztereoizomer lehetséges.
Mutarotáció[szerkesztés]
A D-glükóznak könnyen előállítható a két anomerje (α-D-glükóz, β-D-glükóz) külön-külön: vizes oldatból az α, piridinből a β módosulat kristályosodik ki. Ha a tiszta α-, vagy a tiszta β-módosulatot vízben feloldva az tapasztalható, hogy az oldat forgatóképessége változik: az α-anomer oldatának a kezdeti optikai forgatóképessége (+112°) az egyensúlyi oldatnak megfelelő +52,7°-ra csökken, a β anomer oldatának kezdeti +18,7°-os optikai forgatóképessége +52,7°-ra növekszik. Az optikai forgatóképességnek ezt a változását mutarotációnak nevezzük. Ennek az a magyarázata, hogy a glükóz két módosulata könnyen át tud alakulni egymásba, és az átalakulások következtében egy egyensúlyi elegy alakul ki.
Reakciói[szerkesztés]
Savak, lúgok hatására[szerkesztés]
A glükóz savakkal nem reagál. Lúgok hatására izomer átalakulásokat mutat, a D-glükóz D-fruktózzá és D-mannózzá alakul át. A háromféle cukor egyensúlyi keveréket alkot. Erélyesebb lúgos behatás hatására oxiredukciós folyamatok mennek végbe.
Redukció[szerkesztés]
Ha a glükóz formilcsoportja hidroxilcsoporttá redukálódik, egy nyílt láncú hatértékű alkohol, D-szorbit keletkezik. A D-szorbit cukoralkohol. Édes ízű szilárd anyag, ami a természetben gyümölcsökben fordul elő. Édesítőszerként használják.
Oxidáció[szerkesztés]
A glükóz lúgos közegben könnyen oxidálódik. Enyhébb oxidáció hatására (pl. brómos víz, híg HNO3) szelektíven a glükóz aldehidcsoportja oxidálódik karboxilcsoporttá, glükonsav keletkezik. A glükonsav aldonsav. Instabil, könnyen γ-laktonná alakul.
A glükóz redukáló hatású, Fehling-próbát, ezüsttükörpróbát mutatja. Ez a glükóz nyílt láncú alakjában jelenlévő aldehidcsoporttal magyarázható. Fehling- és ezüsttükör-próbakor is a glükóz enyhe oxidációja játszódik le.
A glükóz erélyesebb oxidációjakor (pl. tömény HNO3 hatására) cukorsav keletkezik. Ekkor az aldehidcsoport és a láncvégi hidroxilcsoport oxidálódik karboxilcsoporttá. A cukorsav az aldársavak közé tartozik.
Ha a glükóz aldehidcsoportja védett (pl. glikozidkötés védi), akkor a láncvégi hidroxilcsoport oxidálódik karboxilcsoporttá, glükuronsav keletkezik. A glükuronsav az uronsavak közé tartozik. Laktolgyűrűt képez. A karboxilcsoport a γ helyzetű hidroxilcsoporttal γ-laktongyűrűt is képezhet.
Előfordulás[szerkesztés]
Szabad állapotban előfordul a természetben egyes gyümölcsökben (pl. a szőlőben, innen a szőlőcukor név). A vérben a koncentrációja éhgyomornál 70–100 mg/100 ml értékek között, szénhidrátgazdag étkezés után 160 mg/100 ml alatt számít normális értéknek.[3] Diszacharidok (pl. szacharóz, maltóz, cellobióz, laktóz) és poliszacharidok (pl. keményítő, glikogén, cellulóz) alkotórésze. A természetben csak a D-glükóz fordul elő.
Előállítása[szerkesztés]
A glükóz iparilag keményítő (például kukorica- vagy burgonyakeményítő) savas vagy enzimes hidrolízisével állítható elő. A burgonyakeményítő savas hidrolízisekor keletkező glükózt „krumplicukornak” szokás nevezni.
A glikolízis folyamata[szerkesztés]
Glikolízis
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lábjegyzetek[szerkesztés]
- ↑ a b c d A glükóz vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. január 8. (JavaScript szükséges) (németül)
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 57. o. ISBN 963 8334 96 7
- ↑ Leitlinie für die postprandiale Diabeteseinstellung (pdf) pp. 22. International Diabetes Federation, 2008 [2011. június 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2011. július 30.)
Források[szerkesztés]
- Bot György: A szerves kémia alapjai
- Bruckner Győző: Szerves kémia, I/2-es kötet
- Furka Árpád: Szerves kémia
- Kovács Kálmán, Halmos Miklós: A szerves kémia alapjai
Kapcsolódó szócikkek[szerkesztés]
|