2019. február 9-én wikipédistatalálkozót tartunk Budapesten. Szeretettel várunk!
Oxigén
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Általános | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Név, vegyjel, rendszám | oxigén, O, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemi sorozat | nemfémek | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Csoport, periódus, mező | 16, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | színtelen 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg | 15,99903–15,99977 g/mol[1][2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronszerkezet | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok héjanként | 2, 6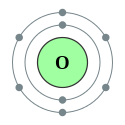
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halmazállapot | gáz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség | (0 °C, 101,325 kPa) 1,429 g/l | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hármaspont | 54,36 K, 152 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont | 54,36 K (-218,79 °C, -361,82 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont | 90,20 K (-182,95 °C, -297,31 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 154,59 K, 5,043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáshő | (O2) 0,444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Párolgáshő | (O2) 6,82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris hőkapacitás | (25 °C) (O2) 29,378 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályszerkezet | köbös | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidációs szám | −2, −1; 0; +1; +2 (semleges oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitás | 3,44 (Pauling-skála) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizációs energia | 1.: 1313,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.: 3388,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.: 5300,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár | 60 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár (számított) | 48 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalens sugár | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-sugár | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egyebek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mágnesség | paramágneses | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hőmérséklet-vezetési tényező | (300 K) 26,58 mW/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | (gáz, 27 °C) 330 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-szám | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fontosabb izotópok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hivatkozások | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Az oxigén a periódusos rendszer kémiai elemeinek egyike. Vegyjele O, rendszáma 8. Neve görög eredetű, a ὀξύς (oxys; ’sav’, szó szerint ’heveny’, utalva a savak savanyú ízére) és a -γενής (-genes; ’nemző’) szavak összetételéből származik; mert elnevezése idején még tévesen úgy gondolták, hogy az oxigén az összes savhoz szükséges összetevő. Régies magyar elnevezése éleny vagy savító.[3] Standard hőmérsékleten és nyomáson az oxigénatomok párosával egymáshoz kötődnek, az így létrejött kétatomos dioxigén (O2) színtelen, szagtalan, íztelen gáz. Ez a molekula a légkör fontos részét képezi, nélkülözhetetlen a szárazföldi élet fenntartásához.
Az oxigén az oxigéncsoport elemei közé tartozik; erősen reaktív nemfémes elem, amely más elemekkel könnyen képez vegyületeket (úgynevezett oxidokat), a három legkönnyebb nemesgáz, a hélium, a neon és az argon kivételével.[4] Az oxigén nagyon erős oxidálószer, az elemek közül csak a fluor elektronegativitása nagyobb.[5] Az oxigén – tömegre vetítve – a világegyetem harmadik leggyakoribb eleme a hidrogén és a hélium után;[6] egyben a Föld leggyakoribb eleme is, hiszen a földkéreg tömegének majdnem felét oxigén teszi ki (természetesen kötött állapotban).[7] Az oxigén kémiailag túl reaktív ahhoz, hogy hosszabb ideig elemi formában megmaradjon a légkörben. Az élő szervezetek fotoszintézise – melynek során a napfény energiájának felhasználásával vízből elemi oxigént állítanak elő – biztosítja folyamatos utánpótlását. A szabad, elemi oxigén mintegy 2,5 milliárd évvel ezelőtt kezdett felhalmozódni a légkörben (nagy oxigenizációs esemény) körülbelül egymilliárd évvel ezen organizmusok első megjelenése után.[8] A kétatomos oxigéngáz a levegő térfogatának 20,8 %-át alkotja.[9]
Az élőlények tömegének legnagyobb részét az oxigén képezi, mert azok fő alkotóeleme a víz (például az emberi testtömeg körülbelül kétharmada).[10] Az oxigén megtalálható az élő szervezetekben előforduló számos fontos szerves kémiai vegyületcsoportban – mint például a fehérjék, nukleinsavak, szénhidrátok, és zsírok –, akárcsak a jelentős szervetlen vegyületekben, amelyek az állati fogakat, csontokat, héjakat, páncélokat alkotják. A cianobaktériumok, algák és növények által termelt elemi oxigént minden bonyolult élet a sejtlégzéskor használja fel. Az oxigén mérgező a szigorúan anaerob szervezetek számára, melyek a korai élet domináns formái voltak a Földön, amíg az O2 el nem kezdett felhalmozódni a légkörben. Az oxigén allotróp módosulata, az ózon (O3), jelentős mértékben elnyeli az UV-B sugárzást, így a nagy magasságban kialakult ózonréteg megvédi a bioszférát az ultraibolya sugárzás káros hatásaitól. Az ózon ugyanakkor a felszín közelében a szmog melléktermékeként kialakuló szennyezőanyag. Ennél nagyobb magasságban, alacsony Föld körüli pályán az atomos oxigén jelentős mennyiségben van jelen, ez okozza az űrjárművek erózióját.[11]
Az oxigént egymástól függetlenül fedezte fel Carl Wilhelm Scheele 1773-ban (vagy korábban) Uppsalában; illetve Joseph Priestley 1774-ben Wiltshire-ben; mivel azonban Priestley munkája előbb jelent meg, gyakran neki tulajdonítják az elsőséget. Az oxigén nevet Antoine Laurent de Lavoisier francia kémikus alkotta meg 1777-ben,[12] akinek az elemmel elvégzett kísérletei hozzájárultak az égés és korrózió akkoriban népszerű flogisztonelméletének megcáfolásában. Az oxigént az iparban cseppfolyósított levegő szakaszos lepárlásával; víz elektrolízisével; illetve zeolitok és nyomás adszorpció (pressure swing adsorption) alkalmazásával állítják elő. Az oxigént számos területen alkalmazzák, beleértve a műanyag-, textil- és acélgyártást; az acél és más fémek forrasztását, hegesztését és vágását; a rakéta-hajtóanyagot; az oxigénterápiát; illetve a repülőgépek, tengeralattjárók, az űrrepülés és a búvárkodás létfenntartó rendszereit.
Tartalomjegyzék
Tulajdonságai[szerkesztés]
Szerkezete[szerkesztés]
Standard hőmérsékleten és nyomáson az oxigén színtelen, szagtalan gáz. Molekulaképlete O2, melyben a két oxigénatom triplett spinű elektronkonfigurációban kapcsolódik egymáshoz. Ennek a kötésnek a kötésrendje 2, de gyakran egyszerűen csak kettős kötésként[13] vagy egy kételektronos és két háromelektronos kötés kombinációjaként hivatkoznak rá.[14]
A triplett oxigén (nem tévesztendő össze az O3 vegyképletű ózonnal) az alapállapotú dioxigén molekula.[15] A molekula elektronszerkezete két párosítatlan elektront tartalmaz, melyek két degenerált molekulapályán találhatóak.[m 1] Ezek a molekulapályák lazítónak minősülnek (a kötésrendet háromról kettőre csökkentik); így a kétatomos oxigén kötése gyengébb, mint a kétatomos nitrogén hármas kötése.[15]
Normál triplett állapotban a dioxigénmolekula paramágneses, azaz a párosítatlan elektronok spinjének mágneses momentuma és a szomszédos molekulák közötti negatív kicserélődési energia miatt az oxigén mágneses mező jelenlétében mágnest alkot.[16] A folyékony oxigén olyan mértékben vonzódik a mágneshez, hogy laboratóriumi bemutatók során egy erős mágnes pólusai között kialakult folyékony oxigénhíd akár még saját súlyát is képes lehet megtartani.[17][m 2]
A szingulett oxigén több, nagyobb energiájú (gerjesztett állapotú) molekuláris oxigén fajtát takar, amelyekben az összes elektronspin párosított. Sokkal reakcióképesebb a szerves molekulákkal szemben, mint önmagában a közönséges dioxigén. A természetben a szingulett oxigén általában vízből, fotoszintézis során keletkezik, a napfény energiájának felhasználásával.[19] A troposzférában az ózon fotolízise által keletkezik, rövid hullámhosszú fény hatására;[20] valamint az immunrendszer is előállítja, mint aktív oxigén forrás.[21] A fotoszintetizáló organizmusokban (és esetleg még az állatokban) található karotinoidok fontos szerepet játszanak a szingulett oxigén energiájának elnyelésében, és gerjesztetlen alapállapotúvá alakításában; még mielőtt az kárt okozhatna a szövetekben.[22]
Allotróp módosulatai[szerkesztés]
Az elemi oxigén leggyakoribb allotróp módosulata a Földön az O2 vegyképletű dioxigén. Ebben a molekulában a kötés hossza 121 pm, a kötés energiája pedig 498 kJ·mol−1.[23] Ez az oxigén azon formája, amelyet a komplex élet a sejtlégzés során hasznosítani tud, illetve amely a Föld légkörének jelentős részét teszi ki.

A trioxigén (O3) vagy ismertebb nevén ózon, az oxigén egy nagyon reaktív allotrópja, amely károsítja a tüdőszöveteket.[24] Az ózon a felső légkörben keletkezik, amikor az O2 atomos oxigénnel egyesül; ez utóbbi a kétatomos oxigénmolekula ultraibolya (UV) sugárzás általi felhasítása révén jön létre.[12] Mivel az ózon jól elnyeli az elektromágneses sugárzás UV tartományba eső részét, ezért a földi felső légkör ózonrétege mintegy védőpajzsként szolgál e sugárzással szemben.[12] Közel a Föld felszínéhez azonban az ózon szennyezőanyag, amely a gépjárművek kipufogógázainak melléktermékeként alakul ki.[24] A metastabil tetraoxigén (O4) molekulát 2001-ben fedezték fel,[25][26] és azt feltételezték, hogy a szilárd oxigén hat fázisának egyikében létezik. 2006-ban igazolták, hogy ez a 20 GPa nyomáson létrejövő fázis valójában romboéderes O8 klaszter.[27] Ez a klaszter potenciálisan sokkal erősebb oxidálószer, mint akár az O2, akár az O3, ezért felhasználható lehet rakéta-hajtóanyagban.[25][26] Fémes fázisát 1990-ben fedezték fel, amikor szilárd oxigént 96 GPa feletti nyomásnak tettek ki,[28] 1998-ban pedig kimutatták, hogy ez a fázis nagyon alacsony hőmérsékleten szupravezetővé válik.[29]
Fizikai tulajdonságai[szerkesztés]
Az oxigén apoláris tulajdonsága miatt a vízben rosszul, bár a nitrogénnél jobban oldódik. A levegővel egyensúlyi állapotban levő vízben két oldott N2-molekulára körülbelül egy O2-molekula jut, szemben a légköri mintegy 4:1-es aránnyal. Az oxigén vízoldhatósága hőmérsékletfüggő, 0 °C-on körülbelül kétszer annyi (14,6 mg/l), mint 20 °C-on (7,6 mg/l).[30][31] 25 °C-on, normál légköri nyomáson (101,3 kPa) az édesvíz literenként körülbelül 6,04 milliliter; míg a tengervíz literenként körülbelül 4,95 milliliter oxigént tartalmaz.[32] 5 °C-on az oldhatóság édesvíz esetében 9,0 milliliterre; tengervíz esetében 7,2 milliliterre emelkedik literenként.
Az oxigén −182,95 °C-on (90,20 K) lecsapódik, és −218,79 °C-on (54,36 K) megfagy.[33] Folyékony és szilárd halmazállapotban is tiszta, halvány égkék színű anyag; színét a vörös tartományba eső fény abszorpciója okozza (ellentétben az ég kékjével, melynek oka a kék fény Rayleigh-szórása). Nagy tisztaságú folyékony oxigént általában cseppfolyósított levegő szakaszos lepárlásával (frakcionált desztilláció) állítanak elő.[34] Folyékony oxigént a levegőből történő kondenzálásával is elő lehet állítani, ehhez folyékony nitrogén hűtőközeget használnak. A cseppfolyós oxigén rendkívül reakcióképes anyag, gyúlékony anyagoktól el kell különíteni.[35]
Kémiai tulajdonságai[szerkesztés]
Az oxigén szobahőmérsékleten kevéssé reakcióképes, magasabb hőmérsékleten azonban csaknem minden elemmel egyesül. Szobahőmérsékleten is képes oxidálni elemeket, magas hőmérsékleten exoterm reakcióban egyesül velük (égés). Erős oxidálószer, az oxidáció a vele kapcsolatos megfigyelések folyományaként kapta a nevét. Apoláris oldószerekben jól oldódik. Az egyatomos oxigén (mint minden naszcensz atom) annyira reagens, hogy a természetben csak nagyon rövid ideig létezik (jelölése 'O').
- reakciója fémekkel:
- reakciója nemfémes elemekkel:
- reakciója szervetlen vegyületekkel:
- reakciója szerves vegyületekkel:
- az ózonképződés egyenlete: (reverzibilis)
Izotópjai[szerkesztés]
A természetben előforduló oxigén három stabil izotópból áll: 16O, 17O és 18O; melyek közül a leggyakoribb az oxigén-16 (természetes előfordulása 99,762 %).[36] A legtöbb oxigén-16 a nagyobb tömegű csillagokban, a hélium fúzió (háromalfa-ciklus) végén szintetizálódik, de valamennyi a neon-égési folyamat során is keletkezik.[37] Az oxigén-17 izotóp elsősorban a CNO-ciklus során keletkezik, melyben a hidrogén héliummá ég el; így gyakori izotóp a csillagok hidrogén-zónájában.[37] Az oxigén-18 legnagyobb részben akkor keletkezik, amikor a CNO-ciklusban létrejött 14N befogja a 4He atommagot. Emiatt az oxigén-18 a fejlett, nagy tömegű csillagok héliumban gazdag zónáiban gyakori izotóp.[37]
Az oxigén tizennégy radioizotópja ismert. 122,24 másodperc felezési idővel a legstabilabb az oxigén-15, őt követi az oxigén-14, melynek felezési ideje 70,606 s.[36] Az összes többi radioaktív izotóp felezési ideje kevesebb, mint 27 s; de a többségre elmondható, hogy 83 ms-nél is rövidebb.[36] Az 16O-nál könnyebb radioizotópok leggyakoribb bomlási módja a β+ bomlás,[38][39][40] amely nitrogént eredményez; a 18O-nál nehezebb izotópok béta-bomlása fluor keletkezéséhez vezet.[36]
Előfordulása[szerkesztés]
| Z | Elem | Koncentráció (ppm) |
|---|---|---|
| 1 | Hidrogén | 739 000 |
| 2 | Hélium | 240 000 |
| 8 | Oxigén | 10 400 |
| 6 | Szén | 4600 |
| 10 | Neon | 1340 |
| 26 | Vas | 1090 |
| 7 | Nitrogén | 960 |
| 14 | Szilícium | 650 |
| 12 | Magnézium | 580 |
| 16 | Kén | 440 |
Az oxigén a földi bioszféra; a légkör, a tengerek és a szárazföldek tömegének leggyakoribb kémiai eleme. A hidrogén és a hélium után az oxigén a harmadik leggyakoribb elem az univerzumban.[6] A Nap tömegének körülbelül 0,9 %-át oxigén alkotja.[9] A földkéreg tömegének 49,2 %-a oxigén,[7] és a fő alkotóeleme a világ óceánjainak (88,8 tömegszázalék); mind kötött, mind szabad állapotban előfordul.[9] Az oxigéngáz a Föld légkörének második leggyakoribb eleme (20,8 térfogatszázalék), tömege mintegy 1015 tonna (23,1 tömegszázalék).[9][42][m 3] A Föld szokatlan a Naprendszer bolygói között abban a tekintetben, hogy a légkörben ilyen nagy mennyiségben található meg az oxigéngáz: a marsi (0,1 térfogatszázalék) és vénuszi légkör jóval alacsonyabb koncentrációban tartalmazza. A környező bolygókon azonban az O2 kizárólag az oxigén-tartalmú molekulák (például szén-dioxid) ultraibolya sugárzás hatására történő felhasadása révén jön létre.
A szokatlanul magas oxigén koncentráció a Földön az oxigén ciklus eredménye. Ez a biogeokémiai ciklus írja le az oxigén mozgását annak három fő tározója közt a Földön; melyek: a légkör, a bioszféra és a litoszféra. Az oxigén ciklus legfőbb tényezője a fotoszintézis, amely a Föld mai légköréért is felelős. A fotoszintézis ugyanis oxigént szabadít fel, amely a légkörbe kerül; ezzel szemben a biológiai oxidáció (légzés) és az élőlények pusztulása (bomlás) révén kikerül onnan. A jelenlegi egyensúlyi állapotban az oxigéntermelés és -fogyasztás azonos mértékű, évente körülbelül a teljes légköri oxigén mennyiségének kétezred részét teszi ki.
A világ víztesteiben oldott állapotú szabad oxigén is előfordul. Az O2 alacsonyabb hőmérsékleten megnövekvő oldhatósága fontos következményekkel jár a tengeri életre nézve, a magasabb oxigéntartalom miatt a poláris óceánokban az élet sokkal gazdagabb és sokszínűbb.[43] Ezért (is) okoz komoly problémát, ha kőolaj kerül a víz felszínére, az ugyanis filmréteget képezve elzárja az oxigént a víztől, így az képtelen abban oldódni. A már oldott oxigén ugyanakkor „átvándorol” az olajba, ezzel tovább csökkentve a vízben oldott oxigén mennyiségét. A növényi tápanyagokkal – mint például nitrátokkal és foszfátokkal – szennyezett vizekben az eutrofizációnak nevezett folyamat fokozza az algák növekedését; ezen szervezetek, illetve más bioanyagok lebomlása pedig csökkenthetik az eutróf vizekben oldott oxigén mennyiségét. Ezen okból kifolyólag a tudósok a vízminőség mérésére a víz biokémiai oxigénigényét, vagy a normál koncentráció visszaállításához szükséges oxigén mennyiséget használják.[44]
Élettani szerepe[szerkesztés]
Fotoszintézis és sejtlégzés[szerkesztés]
A természetben, a szabad oxigén a fotoszintézis – a víz fényenergia hatására való elbontása – során keletkezik. Egyes becslések szerint, a tengerekben élő zöldmoszatok és cianobaktériumok állítják elő a Földön található szabad oxigén mintegy 70%-át, és csupán a többit termelik meg a szárazföldi növények.[45] A különböző becslések az atmoszférikus oxigénhez való óceáni hozzájárulás mértékét magasabbra, mások alacsonyabbra teszik; összességében azt sejtetve, hogy az óceánok a légköri oxigén 45%-át termelik meg évente.[46] A fotoszintézis folyamatának egyszerűsített képlete:[47]
vagy egyszerűbben:
- szén-dioxid + víz + napfény → glükóz + dioxigén
A fotolitikus oxigén-fejlődés a fotoszintetizáló szervezetek tilakoid membránjában következik be, és négy fotonnyi energiát igényel.[m 4] A folyamat sok lépésből áll, végeredményben proton átmenet keletkezik az egész tilakoid membránon, amely a fotofoszforiláció során adenozin-trifoszfátot (ATP) szintetizál.[48] A vízmolekula oxidációja után hátramaradt dioxigén ezután a légkörbe távozik.[m 5] A molekuláris dioxigén (O2) az összes aerob szervezet sejtlégzéséhez elengedhetetlen. Az oxigén a mitokondriumban hasznosítódik: az oxidatív foszforiláció során segíti az ATP keletkezését. Az aerob légzés folyamata lényegében fordított fotoszintézis, egyszerűsített felírással:
A gerincesekben, az oxigén a átdiffundál membránon keresztül a tüdőbe majd a vörösvérsejtekbe. Itt a hemoglobin megköti a dioxigént, ezzel a színét kékes vörösről világos vörössé változtatva.[24] (A hemoglobin más részén a Bohr-effektus révén szén-dioxid szabadul fel). Más állatok hemocianint (puhatestűek és néhány ízeltlábú), vagy hemeritrint (pókok és homárok) használnak.[42] Egy liter vér 200 cm3 O2-t képes feloldani.[42] A reaktív oxigén-gyökök, mint például a szuperoxid-ion (O2-) és a hidrogén-peroxid (H2O2), az organizmusok oxigén-felhasználásának veszélyes melléktermékei.[42] A magasabb rendű szervezetek immunrendszereinek bizonyos részei azonban létrehozhatnak peroxidot, szuperoxidot és szinglett oxigént, hogy elpusztítsák a támadó mikrobákat. Ezek a gyökök szintén fontos szerepet játszanak a növények kórokozó-támadásra adott hiperszenzitív válaszában.[48]
Emberi szervezet[szerkesztés]
| Egység | Alveoláris tüdő gáz nyomás |
Artériás vér oxigén |
Vénás vér oxigén |
|---|---|---|---|
| kPa | 14,2 | 11[49]-13[49] | 4,0[49]-5,3[49] |
| mmHg | 107 | 75[50]-100[50] | 30[51]-40[51] |
Az oxigén parciális nyomása egy élő gerinces szervezetében a légzőrendszerben a legmagasabb, majd az artériák, a perifériás szövetek és a vénák mentén haladva egyre csökken. Az oxigén parciális nyomása, az a nyomás, amely akkor lenne, ha egyedül töltené ki a rendelkezésre álló teret.[52]
Egy nyugalmi állapotban lévő felnőtt ember 1,8-2,4 gramm oxigént lélegez be percenként.[53] Ez a teljes emberiségre vetítve évente több mint 6 milliárd tonna belélegzett oxigént jelent.[m 6]
Az atmoszféra felépítése[szerkesztés]
A szabad oxigéngáz szinte nem is létezett a Föld légkörében a fotoszintetikus archeák és baktériumok 3,5 milliárd évvel ezelőtti kifejlődését megelőzően. Az oxigén jelentősebb mennyiségben először a paleoproterozoikum eon (2,5 és 1,6 milliárd évvel ezelőtt) idején jelent meg. Az első egymilliárd évben, minden oxigén, amelyet ezen organizmusok termeltek egyesült az óceánokban oldott vassal; sávos vas formációkat (üledékes kőzet) hozva létre. Amikor 2,7 milliárd évvel ezelőtt az ilyen oxigén-elnyelők telítetté váltak, az oxigén kilépett az óceánokból, és mintegy 1,7 milliárd évvel ezelőtt elérte a jelenlegi szint 10 %-át.[54]
A nagy mennyiségű oldott és szabad oxigén jelenléte az óceánokban és a légkörben, a legtöbb anaerob organizmust kipusztította a mintegy 2,4 milliárd évvel ezelőtti nagy oxigenizációs esemény (oxigén katasztrófa) folyamán. Ugyanakkor, lehetővé tette a O2-t sejtlégzésre használó aerob organizmusok számára, hogy sokkal több ATP-t állítsanak elő; ezzel elősegítette, hogy azok uralják a földi bioszférát.[55]
A kambrium időszak 540 millió évvel ezelőtti kezdete óta, az O2-szint 15 és 30 térfogatszázalék között ingadozott.[56] A légköri oxigén szintje a karbon korszak vége felé (mintegy 300 millió évvel ezelőtt) érte el maximumát 35 térfogatszázalékkal;[56] amely jelentősen hozzájárulhatott a nagy számú rovarhoz és kétéltűhöz ebben az időben.[57] Az emberi tevékenység, beleértve az évi 7 milliárd tonna fosszilis tüzelőanyag elégetését, nagyon kevés hatással van a légköri oxigén mennyiségére.[16] A jelenlegi ütem mellett a fotoszintézis körülbelül 2000 év alatt újítja meg a teljes légköri O2-mennyiséget.[58]
Története[szerkesztés]
Korai kísérletek[szerkesztés]
Az egyik legkorábbi, az égés és a levegő kapcsolatát vizsgáló kísérletet Bizánci Philón görög mérnök végezte el az időszámításunk előtti 2. században. A Pneumatica című munkájában leírt kísérletében Philón egy égő gyertyát egy másik edénnyel takart le, és a nyakát vízzel vette körbe. Megfigyelte, hogy a víz kismértékben felemelkedett az edény nyakában.[59] Philón tévesen azt gondolta, hogy az edényben lévő levegő egy része átalakult a klasszikus tűz elemmé, és így képes volt kijutni az üveg pórusain. Sok évszázaddal később Leonardo da Vinci vitte tovább Philón munkáját megfigyelve, hogy a levegő egy része felhasználódik az égés és a légzés során.[60]
A 17. század végén Robert Boyle bebizonyította, hogy a levegő az égés szükséges feltétele. John Mayow (1641–1679) angol kémikus tovább finomította Boyle munkáját azzal, hogy megmutatta, a tűz csak a levegő egy részét használja fel, melyet ő spiritus nitroaereusnak vagy csak nitroaereusnak nevezett.[61] Kísérletében azt találta, hogy egy egeret vagy egy égő gyertyát a zárt edény alá helyezve a víz megemelkedett, és a levegő eredeti térfogatának 14 százalékát töltötte ki, mielőtt a vizsgált tárgyak elenyésztek.[62] Ebből arra a feltételezésre jutott, hogy mind a légzés, mind az égés nitroaereust fogyaszt.
Mayow megfigyelte, hogy az antimon súlya hevítés hatására megnő; ebből arra következtetett, hogy a nitroaereus egyesül azzal.[61] Arra is rájött, hogy a tüdő elválasztja a nitroaereust a levegőtől, és átadja azt a vérnek; illetve, hogy az állati hő- és izommozgás a nitroaereus és a szervezetben lévő más anyagok reakciójából ered.[61] Ezeket, illetve más elvégzett kísérleteit és gondolatait 1668-ban, Tractatus duo című munkájának De respiratione fejezetében publikálta.[62]
Flogisztonelmélet[szerkesztés]

Robert Hooke, Ole Borch, Mihail Lomonoszov és Pierre Bayen valamennyien előállították az oxigént a 17. és a 18. századi kísérleteikben, de egyikük sem ismerte fel, hogy az egy új kémiai elem.[30] Ez részben az égés és a korrózió úgynevezett flogisztonelméletének is köszönhető, amely igen népszerű volt abban az időben.
A Johann Joachim Becher német alkimista által 1667-ben felállított, és a Georg Ernst Stahl kémikus által 1731-ben módosított flogisztonelmélet azt állította, hogy minden éghető anyag két részből áll.[63] Az egyik rész, az úgynevezett flogiszton, az égés során távozott az anyagból; míg a másik, flogisztontartalmától megfosztott részről azt gondolták, hogy az az anyag igazi formája, vagy más néven calx.[60]
A jól égő, és kevés maradékot (hamut) hagyó anyagokról, mint például a fáról vagy a szénről, azt gondolták, hogy nagyrészt flogisztonból épülnek fel; míg a nem éghető, korrodálódó anyagok, mint a vas, csak kis részben tartalmazzák. A levegő nem játszott szerepet a flogisztonelméletben, és nem történtek kezdetleges, mennyiségi kísérletek sem az elmélet igazolására. Ehelyett, az elméletet arra alapozták, hogy mi történik ha valami elég; és megállapították, hogy a hétköznapi tárgyak az elégetés hatására könnyebbnek tűnnek, mintha elveszítenének valamit a folyamatban.[60] Azt a tényt, hogy az elégett anyag, például a fa tömege megnő az égés során, a gáznemű égéstermékek felhajtóereje elrejtette. A fémek voltak az első nyomai a flogisztonelmélet hibás mivoltának, ugyanis tömegük a rozsdásodás hatására megnőtt, habár az elmélet szerint azok is flogisztont veszítettek.
Felfedezése[szerkesztés]

Az oxigént a svéd gyógyszerész, Carl Wilhelm Scheele fedezte fel. Higany-oxid és a különböző nitrátok hevítésével 1772-ben sikerült oxigéngázt előállítania.[9][60] Scheele tüzes levegőnek nevezte el a gázt, mert ez volt az égés egyetlen ismert támogatója. Felfedezéséről Értekezés a levegőről és a tűzről címmel beszámolót is írt, és 1775-ben elküldte kéziratát a kiadónak. Ugyanakkor, a dokumentumot 1777-ig nem publikálták.[64]

Időközben, 1774. augusztus 1-jén, a brit lelkész Joseph Priestley is elvégzett egy kísérletet: a Nap fényét üvegcsőben elhelyezett higany-oxidra (HgO) fókuszálta, amely gázt szabadított fel; ezt a gázt Priestley deflogisztonizált levegőnek nevezte el.[9] Felfedezte, hogy a gyertyák fényesebb lánggal égnek benne, illetve az egér aktívabb volt és tovább élt, ha belélegezte a gázt. Miután ő maga is belélegezte, ezt írta: „A tüdőm nem érzett különbséget a közönséges levegőtől, de úgy emlékszem, hogy utána egy ideig különösen könnyednek éreztem a mellkasom.”[30][65] Priestley 1775-ben publikálta felfedezéseit Beszámoló további felfedezésekről a levegővel (An Account of Further Discoveries in Air) című tanulmányában; amely a Kísérletek és megfigyelések különböző levegőkkel című könyvének második kötetében volt olvasható.[60][66] Mivel előbb publikálta eredményeit, általában Priestley-nek tulajdonítják a felfedezés elsőségét.
A neves francia kémikus, Antoine Laurent Lavoisier később azt állította, hogy az új anyagot önállóan fedezte fel. Priestley azonban 1774 októberében meglátogatta, és elmondta neki a kísérletét, és miképp szabadította fel az új gázt. Scheele is írt egy levelet Lavoisier-nek 1774. szeptember 30-án, melyben leírta a korábban ismeretlen anyag felfedezését, de Lavoisier sosem ismerte el, hogy megkapta azt (a levél másolatát Scheele ingóságai között találták meg halála után).[64]
Lavoisier hozzájárulása[szerkesztés]
Amit Lavoisier kétségkívül megtett (bár azt abban az időben még vitatták), az az oxidáció első, megfelelő mennyiségi kísérletének elvégzése volt; illetve elsőként magyarázta meg helyesen az égés folyamatát.[9] 1774-től kezdődően elvégezte ezeket, illetve más hasonló kísérleteket; hogy megcáfolja a flogisztonelméletet és bebizonyítsa, hogy a Priestley és Scheele által felfedezett anyag egy új kémiai elem.
Az egyik kísérletben Lavoisier megfigyelte, hogy amikor ónt és levegőt hevített egy zárt tartályban, összességében nem volt súlygyarapodás.[9] A tartály felnyitásakor azt tapasztalta, hogy kívülről levegő áramlott be; ami azt jelezte, hogy a tartályban lévő levegő egy része elhasználódott. Azt is megfigyelte továbbá, hogy az ón tömege megnőtt; méghozzá pontosan a beáramolt levegő tömegével azonos mértékben. Ezt, és az égéssel kapcsolatos más kísérleteit a Sur la combustion en général című könyvében dokumentálta, melyet 1777-ben publikáltak.[9] Ebben a művében azt bizonyította, hogy a levegő két gáz keverékéből áll: a létfontosságú (vital) levegőből, amely elengedhetetlen az égéshez és a légzéshez; illetve az azótból (görög: ἄζωτον "élettelen"), amelyik egyiket sem táplálta. Az azót ma magyarul a nitrogén néven ismert elem, de franciául és néhány európai nyelven még mindig így hívják.[9]
Lavoisier 1777-ben átnevezte a létfontosságú (vital) levegőt a görög eredetű – az ὀξύς (oxys) ’sav’ és -γενής (-genēs) ’nemző, képző’ szavak összetételéből származó – oxygène-re, mert tévesen azt hitte, hogy az oxigén minden sav alkotóeleme.[12] A kémikusok (nevezetesen Sir Humphry Davy 1812-ben) végül bebizonyították, hogy Lavoisier tévedett ebben a tekintetben (a sav-bázis kémia sarokköve ugyanis a hidrogén-ion), de ekkor már túl késő volt.
Későbbi története[szerkesztés]
John Dalton eredeti atomhipotézise azt feltételezte, hogy minden elem monoatomikus, és hogy a vegyületekben lévő atomok a legegyszerűbben aránylanak egymáshoz. Például Dalton azt gondolta, hogy a víz képlete HO, így az oxigén atomtömege nyolcszorosa a hidrogénének, szemben a mai 16-szoros értékkel.[67] 1805-ben Joseph Louis Gay-Lussac és Alexander von Humboldt megmutatta, hogy a víz két térfogatrész hidrogénből és egy térfogatrész oxigénből áll; 1811-ben pedig Amedeo Avogadro megadta a víz összetételének helyes értelmezését, a később róla elnevezett Avogadro-törvény és a kétatomos molekulák létezésének feltételezése alapján.[68][m 7]
A 19. század végére a tudósok felismerték, hogy a levegő cseppfolyósítható és az összetevői szétválaszthatók, ha a levegőt komprimálják (összenyomják), és lehűtik. A svájci kémikus és fizikus, Raoul Pictet Pierre kaszkád módszer alkalmazásával folyékony kén-dioxidot párologtatott el annak érdekében, hogy így folyékony szén-dioxidot állítson elő, amit aztán szintén elpárologtatott, hogy kellően le tudja hűteni az oxigéngázt a cseppfolyósodáshoz. 1877. december 22-én táviratot küldött a párizsi Francia Tudományos Akadémiának, hogy bejelentse a folyékony oxigén felfedezését.[69] Mindössze két napra rá, Louis Paul Cailletet francia fizikus is bejelentette saját módszerét a folyékony molekuláris oxigén előállítására.[69] Mindkét esetben csupán néhány cseppnyi folyadékot sikerült előállítani, így értelmes elemzést nem lehetett elvégezni. Stabil állapotú folyékony oxigént először a lengyel Jagelló Egyetem tudósainak (Zygmunt Wróblewski és Karol Olszewski) sikerült előállítania 1883. március 29-én.[70]
1891-ben James Dewar skót vegyész képes volt a tanulmányozáshoz elegendő mennyiségű folyékony oxigént előállítani.[16] Az első kereskedelmileg is életképes folyékonyoxigén-előállító eljárást 1895-ben egymástól függetlenül fejlesztette ki Carl von Linde német és William Hampson brit mérnök. Mindketten addig csökkentették a levegő hőmérsékletét, amíg az folyékonnyá nem kondenzálódott; majd az összetevő gázokat egyesével felforralva desztillációval különválasztották.[71] Később, 1901-ben bemutatták az oxiacetilén hegesztést, amelyben sűrített O2-t és acetilént kevertek és égettek el. Ez a hegesztési, illetve lemezvágási eljárás később széles körben elterjedt.[71]
1923-ban Robert H. Goddard amerikai tudós lett az első ember akinek sikerült rakétahajtóművet építenie. A hajtóműve benzint használt tüzelőanyagként, és folyékony oxigént oxidálószerként. Goddard sikeresen lőtt fel egy kis folyékony üzemanyagú rakétát 1926. március 16-án a massachusettsi Auburnban 56 m magasra, 97 km/h sebességgel.[71][72]
Előállítása[szerkesztés]
Az iparban évente 100 millió tonna oxigént állítanak elő a levegőből, melynek két fő eljárása ismert.[64] A leggyakoribb eljárás a levegő szakaszos lepárlása (frakcionált desztilláció) alkotóelemeire, amely során az oxigén folyékony, a nitrogén gőzállapotú.[64]
A másik eljárás, tiszta, száraz levegő zeolit molekuláris szűrőágy-pár egyikén való átáramoltatása, amely elnyeli a nitrogént, és a kiáramló gáz 90-93% oxigéntartalmú.[64] Ezzel párhuzamosan a másik, nitrogénnel telített zeolit ágyban lecsökkentik a kamra üzemi nyomását, illetve fordított irányban átáramoltatják rajta az oxigéngáz áram egy elterelt részét; így a kamrában nitrogéngáz szabadul fel. Adott idő elteltével a kamrák szerepe felcserélődik, így a vezetékekben folyamatos oxigéngáz áramlás tartható fenn. Ez az úgynevezett adszorpciós nyomásfordítás (pressure swing adsorption, PSA). Az oxigéngázt egyre inkább ezekkel a nem-kriogén technológiákkal állítják elő.[73]
Az oxigéngáz víz elektrolízisével is előállítható, mely során a víz molekuláris oxigénre és hidrogénre bomlik. Az elektrolízis során az elektródákra egyenáramot kapcsolnak. Váltóáram esetén mindkét oldali kémcsőben a hidrogén és oxigén robbanásveszélyes 2:1 arányú elegye keletkezik, mivel az anód és a katód a váltóáram frekvenciájának megfelelően folyamatosan felcserélődik. A közhiedelemmel ellentétben, az egyenáramú elektrolízis során tapasztalható 2:1-es arány nem bizonyítja a víz H2O vegyképletét, kivéve, ha élünk bizonyos feltételezésekkel a hidrogén és az oxigén formulájáról magáról. Hasonló módszer az oxidok és oxosavak elektrokatalitikus O2-evolúciója. Természetesen kémiai katalizátorok is használhatóak, mint például a kémiai oxigén generátor vagy az oxigéngyertya, amelyeket a tengeralattjárók létfenntartó rendszerébe építenek be, illetve alapfelszereltségként alkalmazzák a kereskedelmi repülőgépjáratokon dekompressziós vészhelyzet esetén. További levegő-szeparációs technológia a levegő nagy nyomás hatására, vagy elektromos áram révén kényszerített feloldása cirkónium-dioxidból készült kerámia membránokban, amely során csaknem tiszta oxigéngáz termelődik.[44]
A folyékony oxigén ára nagy mennyiségben, 2001-ben körülbelül 0,21 $/kg (47,8 Ft/kg) volt.[74][m 8] Mivel az elsődleges termelési költség a levegő cseppfolyósításának energiaköltsége, a termelési költségek az adott terület energiaárai alapján változnak.
Gazdasági okokból az oxigént gyakran cseppfolyós állapotban, speciálisan szigetelt tankerekben szállítják, mivel egy liter cseppfolyós oxigén légköri nyomáson és 20 °C-on 840 liter oxigéngázzal egyenértékű.[64] Az ilyen tankerekkel töltik fel a kórházak és egyéb nagy mennyiségű tiszta oxigéngázt felhasználó intézmények oxigéntároló tartályait, amelyekből a folyékony oxigén hőcserélőkön keresztül áramolva, csak gáz halmazállapotban jut be az épületbe. A sűrített oxigéngázt ugyanakkor nagynyomású, kék színű acélpalackokba is kitöltik és szállítják, ez bizonyos hordozható orvosi eszközökhöz, hegesztéshez és lemezvágáshoz előnyös kiszerelési forma.[64] A palack kezelése rendkívüli elővigyázatosságot igényel a nagy fokú robbanásveszély miatt.
Felhasználása[szerkesztés]
Orvostudomány[szerkesztés]

A légzés alapvető célja az oxigén felvétele a levegőből, így az oxigénpótlást a gyógyászatban is használják. A kezelés nemcsak megnöveli a beteg vérében lévő oxigén szintjét, de megvan az a másodlagos hatása, hogy számos tüdőbetegség esetén csökkenti a vér áramlási ellenállását, így könnyít a szív terhelésén. Az oxigénterápiát használják a tüdőtágulat (emphysema), a tüdőgyulladás, bizonyos szívbetegségek (pangásos szívelégtelenség) kezelésére; illetve minden olyan betegségnél és rendellenességnél, amely a tüdőartéria fokozott vérnyomásával jár együtt, vagy rontja a szervezet oxigénfelvevő képességét.[75]
A kezelés elég rugalmas ahhoz, hogy ne csak a kórházakban alkalmazzák, de akár a beteg otthonában, vagy egyre inkább hordozható eszközök segítségével. Régebben elterjedt volt az oxigénsátor alkalmazása, de mára szinte teljesen felváltotta az oxigénmaszk és a nazális kanül.[76]
A hiperbár (nagynyomású) gyógyászat speciális oxigénkamrát használ, hogy megnövelje az oxigén parciális nyomását a páciens – és ha szükséges – az orvosi személyzet körül.[77] A szén-monoxid-mérgezés, a gázgangréna (sercegő üszök) és a dekompressziós betegség kezelhető a segítségével.[78] A megnövelt O2-koncentráció a tüdőben segít kiszorítani a szén-monoxidot a hemoglobin hem csoportjából.[79][80] Az oxigéngáz mérgező a gázgangrénát okozó anaerob baktériumok számára, így a parciális nyomás megemelése segít megölni őket.[81][82] A dekompressziós betegség túl gyorsan emelkedő búvárok esetében fordul elő, akik vérében inert gázbuborékok – főleg nitrogén és hélium – keletkezik. A kezelés része az oxigén nyomásának minél hamarabbi megnövelése.[75][83][84]
Oxigént használnak azoknál a betegeknél is, akiknél gépi lélegeztetés szükséges; gyakran a környezeti levegő 21%-os koncentrációját meghaladó mértékben.
Létfenntartás és kikapcsolódás[szerkesztés]
Az oxigéngáz figyelemre méltó alkalmazási területe a modern űrruha, amely körülöleli a viselő testét a kis nyomású gázzal. Egyes űrruhákban csaknem tiszta oxigént alkalmaznak, melynek nyomása körülbelül egyharmada a normál légköri nyomásnak, így tartva fenn az oxigén normális parciális nyomását a vérben.[85][86] A nagy nyomásról kis nyomásra való átváltás azért volt szükséges, hogy továbbra is megfelelően rugalmas és hajlékony ruhákat lehessen készíteni.
A búvárok és a tengeralattjárón szolgáló tengerészek is mesterségesen szállított oxigénre támaszkodnak, de a leggyakrabban normál nyomást vagy levegő és oxigén keverékét használják. A tiszta vagy majdnem tiszta oxigén használata a búvárkodásban az újralégző készülékre; illetve a dekompresszió, vagy sekély mélységű (~6 méter mély, vagy kevesebb) sürgősségi kezelésre korlátozódik.[87][88] Ennél mélyebbre merüléskor az oxigént más gázokkal – nitrogénnel vagy héliummal – jelentősen hígítani kell, hogy elkerüljék az oxigénmérgezést.[87]
A hegymászók és a nem túlnyomásos merevszárnyú repülőgéppel repülők gyakran visznek magukkal kiegészítő oxigént.[m 9] A kereskedelmi (túlnyomásos) repülőgépekkel utazók vészhelyzeti oxigén tartalékkal rendelkeznek, amelyet az utastér nyomáscsökkenése esetén automatikusan megkapnak. A hirtelen nyomáscsökkenés aktiválja az egyes ülések fölötti kémiai oxigén generátorokat, és az oxigénmaszkok leesnek. A maszkok felvétele – a biztonsági előírásoknak megfelelően – a tartály belsejében lévő vasreszeléket a nátrium-klorátba kényszeríti, ezzel az exoterm reakció révén folyamatos oxigéngáz áramlás indul meg.[44]
Az oxigénnek, mint feltételezhetően enyhe euforikus hatású gáznak, nagy múltja van a rekreációs felhasználását illetően az oxigénbárokban és a sportban. Az ilyen oxigénbárok az 1990-es évektől kezdődően megtalálhatóak Japánban, Kaliforniában, és a nevadai Las Vegas völgyben, amelyek térítés ellenében a szokásosnál nagyobb oxigénmennyiséget kínálnak belélegzésre.[89] A profi sportolók, különösen az amerikai futballban a play-ek között időnként elhagyják a pályát, hogy oxigén maszkot viseljenek, és növeljék teljesítményüket. Ezen technikák farmakológiai hatása kétséges, a placebo hatás sokkal valószínűbb magyarázat.[89] A rendelkezésre álló tanulmányok alátámasztják a dúsított O2-keverék teljesítménynövelő hatását, de csak akkor, ha azt a testmozgás alatt lélegezték be.[90]
Az oxigén további felhasználási területe lehet a pirotechnika, többek között George H. Goble öt másodperces barbecue grillsütése (folyékony oxigén felhasználásával).[91]
Ipar[szerkesztés]
A vasérc acéllá alakítása használja fel a kereskedelmileg előállított oxigén 55%-át.[44] Ez az eljárás az úgynevezett LD-konverteres eljárás, amely során a konverterben felhevített, olvadt nyersvasra egy felülről beengedett oxigénlándzsán keresztül nagy sebességgel oxigéngázt fújnak be. Az oxigén kiégeti a nyersvasban lévő kén szennyeződéseket, illetve a vas széntartalmát, melyből rendre SO2 és CO2 keletkezik. A reakció exoterm, a konverter hőmérséklete így akár 1700 °C-ig is emelkedhet.[44]
További 25% előállított oxigént a vegyipar használ fel.[44] Az etilént oxigénnel reagáltatva etilén-oxidot állítanak elő, majd abból pedig etilénglikolt. Az etilénglikol számos termék gyártásának elsődleges kiindulóanyaga, beleértve a fagyállót, illetve a poliészter polimereket (amelyek még több műanyag és szövet prekurzorai).[44]
A fennmaradó 20%-ot orvosi célokra, hegesztésre, lemezvágásra, rakéta-hajtóanyaghoz, illetve víztisztításhoz használják fel.[44] Az oxiacetilén hegesztéskor a hegesztőpisztolyban acetilén és oxigéngáz keverékét égetik el, amely rendkívül forró lánggal ég. A lemezvágási eljárásnál a legfeljebb 60 cm vastag lemezt egy kisebb oxiacetilén lánggal előhevítik, majd egy nagyobb oxigénsugárral hirtelen elvágják.[92]
Tudomány[szerkesztés]

A paleoklimatológusok mérik a tengeri élőlények héjában és vázában található oxigén-16 és oxigén-18 izotópok mennyiségét, hogy meghatározzák milyen volt az éghajlat évmilliókkal ezelőtt. A tengervíz molekulái, amelyek a könnyebb oxigén-16 izotópot tartalmazzák, valamivel gyorsabb ütemben párolognak el, mint a 12%-kal nehezebb oxigén-18 izotópot tartalmazó vízmolekulák; ez a különbség alacsonyabb hőmérsékleten növekszik.[93] Az alacsonyabb globális hőmérsékletű időszakok során az elpárolgott vízből keletkező hó és eső általában oxigén-16-ban, a hátrahagyott tengervíz pedig általában oxigén-18-ban gazdagabb. A tengeri élőlények így több oxigén-18 izotópot építenek be a vázszerkezetükbe, mint tennék azt melegebb éghajlat esetén.[93] A paleoklimatológusok követlenül is mérik ezt az arányt a jégmag mintákból származó vízmolekulákban, amelyek akár több százezer évesek is lehetnek.
A planetáris geológusok az oxigénizotópok előfordulási gyakoriságára különböző értékeket mértek a Földről, a Holdról, a Marsról és meteoritokról származó mintákban, de a Napra jellemző izotópgyakorisági értéket még nem sikerült meghatározni – utóbbiról feltételezik, hogy azonos az ősi szoláris ködével (primordial solar nebula). Ugyanakkor a földbe csapódott Genesis űrszonda által visszahozott, az űrben napszélnek kitett szilícium szeletek elemzése azt mutatta, hogy a Nap nagyobb arányban tartalmaz oxigén-16 izotópot, mint a Föld. Az eredmény azt jelenti, hogy egy még ismeretlen folyamat kimerítette a Nap protoplanetáris korongjának oxigén-16 tartalmát, még mielőtt a porszemcséi összeolvadhattak volna, és létrehozták volna a Földet.[94]
Az oxigén két spektrofotometriás abszorpciós sávval rendelkezik, melyek csúcsai 687 és 760 nm hullámhossznál találhatóak. Néhány távérzékeléssel foglalkozó tudós felvetette, hogy a növényzet egészségügyi állapota vizsgálható lenne műholdas platformról, a vegetáció lombozatának ezen sávokba eső sugárzásának mérése révén.[95] Ez a megközelítés azt használja ki, hogy ezekben a sávokban a növényzet reflexiója elkülöníthető annak fluoreszcenciájától, amely sokkal gyengébb. A mérés technikailag nehezen kivitelezhető az alacsony jel-zaj viszony és a növényzet fizikai struktúrája miatt; de javasolt lehetséges eljárás a szén-körciklus globális nyomonkövetésére.
Vegyületei[szerkesztés]
Az oxigén oxidációs száma szinte minden ismert vegyületében −2.[96] Néhány vegyületében, például a peroxidokban előfordul a −1 oxidációs szám is. Az oxigént más oxidációs állapotban tartalmazó vegyületek nagyon ritkák: −1/2 (szuperoxidok), −1/3 (ozonidok), 0 (elemi állapot, hipofluorossav), +1/2 (dioxigenil), +1 (dioxigén-difluorid) és +2 (oxigén-difluorid).
Oxidok és egyéb szervetlen vegyületek[szerkesztés]
A víz (H2O) a hidrogén oxidja, egyben a legismertebb oxigénvegyület. A vízmolekulában a hidrogénatomok kovalens kötéssel kapcsolódnak az oxigénatomhoz, de ezen kívül további vonzást mutatnak (hidrogénatomonként körülbelül 23,3 kJ/mol) más vízmolekulák oxigénatomjai felé is.[97] Ez a hidrogénkötés 15%-kal közelebb tartja egymáshoz a vízmolekulákat annál, mint ahogy az egy közönséges folyadékban a Van der Waals-erők alapján várható lenne.[98][m 10]
Nagy elektronegativitása miatt az oxigén magas hőmérsékleten majdnem az összes elemmel kémiai kötéseket képez, a megfelelő oxidokat hozva létre. Mindazonáltal több elem szabványos nyomáson és hőmérsékleten is könnyen alkot oxidokat, ennek egyik példája a rozsdásodó vas. Az alumíniumhoz és titánhoz hasonló fémek felülete levegő jelenlétében oxidálódik; vékony, tömör oxidréteg jön létre, amely passziválja a fémet, és lelassítja a további korróziót. Néhány természetben megtalálható nem-sztöchiometrikus átmenetifém-oxidban valamivel kevesebb fém található, mint amennyi a vegyképletéből következne. Például a természetben előforduló FeO (wüstit) valójában Fe1 − xO formában írható fel, ahol x általában 0,05 körüli érték.[99]
Az oxigén egyik vegyülete – a szén-dioxid (CO2) – nyomokban megtalálható a légkörben. A földkéreg kőzeteinek jelentős részét alkotják a különböző elemek oxidjai, mint például a szilícium- (a szilícium-dioxid (SiO2) alkotóeleme a gránitnak és a homoknak), az alumínium- (alumínium-oxid (Al2O3), a bauxitban és korundban), a vas-oxidok (vas(III)-oxid (Fe2O3), a hematit és a rozsda) és a kalcium-karbonát (mészkő). A földkéreg többi részében szintén megtalálhatóak oxigénvegyületek, főleg a különböző komplex szilikátok (a szilikátásványokban). A földkéregnél jóval nagyobb tömegű földköpenyt főként magnézium- és vas-szilikátok alkotják.
A vízoldható szilikátokat (például Na4SiO4, Na2SiO3 és Na2Si2O5) mosószerekként és ragasztókként használják.[100]
Az átmenetifémek esetében az oxigén ligandumként is viselkedik, és fém-O2 kötéseket képez az irídiumatommal a Vaska-komplexben,[101] a platinával a PtF6-ban,[102] valamint a hemoglobin hem csoportjában a központi vassal.
Szerves vegyületek és biomolekulák[szerkesztés]
A legfontosabb oxigéntartalmú szerves vegyületek (az „R” valamilyen szerves csoportot jelöl): alkoholok (R−OH), éterek (ROR), ketonok (R−CO−R), aldehidek (R−CO−H), karbonsavak (R−COOH); észterek (R−COO−R); savanhidridek (R−CO−O−CO−R) és az amidok (RC(O)−NR2). Számos fontos, oxigéntartalmú szerves oldószer ismert, beleértve a következőket: aceton, metanol, etanol, IPA, furán, tetrahidrofurán, dietil-éter, dioxán, etil-acetát, DMF, DMSO, ecetsav és hangyasav. Az aceton ((CH3)2CO) és a fenol (C6H5OH) számos különböző anyag szintéziséhez elengedhetetlen alapanyag. Egyéb fontos, oxigéntartalmú szerves vegyület még a glicerin, a formaldehid, a glutáraldehid, a citromsav, az ecetsav-anhidrid és az acetamid. Az epoxidok olyan éterek, amelyekben az oxigénatom egy háromatomos gyűrű része.
Az oxigén számos szerves vegyülettel szobahőmérsékleten vagy annál alacsonyabb hőmérsékleten spontán reakcióba lép, ezt a folyamatot autooxidációnak nevezzük.[103] A legtöbb szerves vegyület amely oxigént tartalmaz, nem az oxigéngáz közvetlen reakciója során képződik. Az iparban és a kereskedelemben is fontos szerves vegyületek etilén-oxid és perecetsav tartalmú prekurzorok közvetlen oxidálásával gyárthatók.[100]
Az elem szinte mindegyik biomolekulában megtalálható, amely fontos az élet számára (vagy éppen az állította elő). Csak néhány komplex biomolekula, mint például a szkvalén és a karotinok nem tartalmaznak oxigént. A biológiailag releváns szerves vegyületek közül a szénhidrátok tartalmaznak oxigént a legnagyobb tömegarányban. Minden zsír, zsírsav, aminosav és fehérje tartalmaz oxigént (a karbonilcsoportok jelenléte miatt a savakban, illetve azok észter származékaiban). Az oxigén előfordul a biológiailag fontos energiahordozó ADP és ATP molekulák foszfátcsoportjaiban (PO3−4), az RNS és DNS molekula vázában, a purin- és a pirimidinbázisokban (az adenin kivételével), valamint a csontokban kalcium-foszfát és hidroxiapatit formájában.
Naszcensz oxigén[szerkesztés]
A naszcensz latin szó, jelentése ’a születés pillanatában lévő’. A kémiában a keletkezés, kiválás pillanatában lévő, még atomos állapotú elemekre (gázokra) használják. Az ilyen naszcensz elemek atomos állapotuk miatt rendkívül reakcióképesek. Az ózonból és a hidrogén-peroxidból naszcensz oxigén szabadul fel, ezért ezek az anyagok nagyon erős oxidálószerek.
Nevezetes oxidok[szerkesztés]
- Dihidrogén-oxid, víz, H2O
- Hidrogén-peroxid, H2O2
- Lítium-oxid, Li2O
- Berillium-oxid, BeO
- Szén-monoxid, CO
- Szén-dioxid, CO2
- Dinitrogén-oxid, kéjgáz, N2O
- Nitrogén-monoxid, NO
- Nitrogén-trioxid, N2O3
- Nitrogén-dioxid, NO2
- Nitrogén-tetroxid, N2O4
- Dinitrogén-pentoxid, N2O5
- Nátrium-oxid, Na2O
- Magnézium-oxid, MgO
- Alumínium-oxid, Al2O3
- Szilícium-dioxid, kvarc, SiO2
- Foszfor-pentoxid, P2O5
- Kén-dioxid (SIV), SO2
- Kén-trioxid (SVI), SO3
- Kálium-oxid, K2O
- Kálium-peroxid, K2O2
- Kálium-szuperoxid, Kálium-dioxid, KO2
- Kalcium-oxid, égetett mész, CaO
- Titán-dioxid, TiO2
- Mangán-dioxid, MnO2
- Vas(II)-oxid, Wüstit, FeO
- Vas(III)-oxid, vörösvasérc, Fe2O3
- Vas(II, III)-oxid, Fe3O4
- Vanádium(V)-oxid, V2O5
- Volfrám-trioxid, WO3
Leggyakoribb oxigénvegyületek[szerkesztés]
- hidridjei (víz és hidrogén-peroxid)
- szerves vegyületek, pl.: alkoholok, fenolok, karbonsavak, éterek, észterek, aldehidek, ketonok
- szervetlen savak
- oxidok
Biztonság[szerkesztés]
Az NFPA 704 szabvány a sűrített oxigéngázt egészségre nem veszélyes, nem gyúlékony és nem reaktív, ugyanakkor égést segítő oxidálószerként sorolja be. A hűtött, folyékony oxigén (LOX) egészségügyi szempontból 3-as besorolású a kondenzált gőzök okozta hyperoxia fokozott kockázata, illetve a fagyási sérülések miatt; de minden más szempontból azonos a sűrített oxigéngázzal.
Toxicitás[szerkesztés]


A nagy parciális nyomású oxigéngáz (O2) mérgező lehet, amely görcsökhöz és más egészségügyi problémákhoz vezet.[87][105][m 11] Az oxigénmérgezés általában 50 kilopascal (kPa) parciális nyomáson kezd kialakulni, amely egyenlő a normál tengerszinti O2 parciális nyomás (~21 kPa) két és félszeresével vagy más megközelítésben légköri nyomáson (100 kPa) 50%-os oxigén összetételt jelent. Ez elég szélsőséges ahhoz, hogy a hétköznapokban ne okozzon problémát, kivéve a lélegeztetőgépre kötött betegeket, esetükben az oxigénmaszkon keresztül érkező levegőben az oxigén részaránya 30-50 térfogatszázalék (körülbelül 30 kPa normál nyomáson),[30] habár ez az érték a maszk típusától függően széles tartományban változhat.
Egy időben a koraszülötteket oxigéndús levegővel teli inkubátorba helyezték, de ezt a gyakorlatot megszüntették, miután egyes babák megvakultak a túl magas oxigéntartalomtól.[30]
Az űripari alkalmazásokban – mint például a modern űrruhákban és a korai Apollo űrhajókban – a tiszta oxigén belélegzése azért nem okozott gondot, mert az oxigén össznyomása kicsi volt.[85][106] Az űrruha esetében a belélegzett gázkeverékben lévő O2 parciális nyomása 30 kPa (a normál érték 1,4-szerese), míg az űrhajós vérében oldott O2 parciális nyomása alig haladja meg a tengerszinten mérhető értéket.
A tüdő és a központi idegrendszer oxigénmérgezése önálló készülékes (SCUBA) és ipari búvárkodás (felszíni levegőtáplálásos) során is előfordulhat.[30][87] 60 kPa parciális nyomású oxigént tartalmazó gázkeverék huzamosabb ideig történő belélegzése tartós tüdőfibrózist okoz.[107] 160 kPa (1,6 atm) vagy annál nagyobb parciális nyomású oxigéngáznak való kitettség görcsökhöz vezethet, amely a búvárok számára általában végzetes. A rohamokat okozó, és emiatt a búvárok számára legfélelmetesebb akut oxigénmérgezés 21%-os oxigéntartalom mellett 66 m (tiszta, 100% oxigéntartalom esetében már 6 m) mélységben bekövetkezik.[107][108][109][110]
Égés és egyéb veszélyek[szerkesztés]

A rendkívül koncentrált oxigén elősegíti a gyors égést. Tűz- és robbanásveszély áll fenn, ha a koncentrált oxigén és az éghető anyag közvetlen közelségbe kerül; az égés megindításához ugyanakkor valamilyen gyújtóhatásra – például hőre vagy szikrára – is szükség van.[111] Az oxigén maga nem éghető, de az égést táplálja (oxidálószer). A tűzveszélyesség az oxigén azon vegyületeire is fennáll, amelyek magas oxidációs potenciállal rendelkeznek, mivel ezek oxigénnel táplálhatják a tüzet. Ilyen vegyületek például a peroxidok, klorátok, nitrátok, perklorátok és dikromátok.
A tömény oxigén lehetővé teszi, hogy az égés gyorsan és energetikusan terjedjen.[111] A légnemű és folyékony oxigén szállítására használatos acélcsövek maguk is éghető anyagokként viselkednek, ezért az ilyen O2-rendszerek tervezése és gyártása speciális képzettséget igényel annak érdekében, hogy a gyújtóforrások száma minimalizálható legyen.[111]
Az Apollo–1 legénységének halálát egy tűzeset okozta, amely egy indítóállási teszt során keletkezett. A teszt alatt a kapszulát tiszta oxigénnel töltötték fel, azonban a légkörinél valamivel nagyobb nyomással; így a rövidzárlat következtében felcsapó lángok olyan hevesen és gyorsan égtek, hogy az űrhajósok percek alatt megfulladtak.[m 12][112][113]
Ha az elszivárgó folyékony oxigén szerves anyagokba – például fába, aszfaltba vagy petrolkémiai termékekbe – szívódik be, akkor ezen anyagok mechanikai behatásra később kiszámíthatatlanul berobbanhatnak.[111] Más kriogén anyagokhoz hasonlóan az emberi testtel érintkezve a bőr és a szem fagyási sérülését okozhatja.
Megjegyzések[szerkesztés]
- ↑ A pálya kvantummechanikai fogalom, amely az atom vagy molekula körül valamilyen térbeli eloszlással rendelkező hullámtermészetű részecskeként modellezi az elektront.
- ↑ Az oxigén paramágneses tulajdonsága felhasználható az oxigéngáz tisztaságának analitikai meghatározására.[18]
- ↑ A közölt értékek a földfelszín feletti 80 km magasságra vonatkoznak.
- ↑ A tilakoid membrán a kloroplasztisz része az algákban és a növényekben, ezzel szemben a cianobaktériumokban egyszerűen csak a számos membrán egyike. Valójában, a kloroplasztiszról azt feltételezik, hogy a cianobaktériumokból fejlődött ki, melyek egykor szimbiózisban éltek az algák és növények progenerátoraival.
- ↑ A víz oxidációját katalizálják az oxigén-kialakító komplex (OEC) vagy víz-hasító komplex néven ismert mangán-tartalmú enzimek, amelyek összefüggésben vannak a tilakoid membránok lumenális oldalával. A mangán fontos kofaktor, de kalcium és klór is szükséges a reakció végbemeneteléhez. (Raven 2005)
- ↑
- ↑ Ezeket az eredményeket ugyanakkor 1860-ig elutasították. Az elutasítás oka egyrészt azon meggyőződés volt, hogy egy elem atomjainak nincs kémiai affinitása ugyanazon elem más atomjaihoz; másrészt az Avogadro-törvény látszólagos kivételei miatt, melyeket csak később, a disszociáló molekulákkal sikerült megmagyarázni.
- ↑ Mai (2013. június 24.) árfolyamon számítva.
- ↑ Ennek az az oka, hogy a kis nyomású gázkeverékben az oxigén arányának növelése a tengerszinten mért értékhez közelire növeli a belélegzett O2 parciális nyomását.
- ↑ Ezen kívül, mivel az oxigén elektronegativitása a hidrogénénél nagyobb, a töltéskülönbség miatt a molekula poláris lesz. A különböző molekulák dipólusai közötti kölcsönhatás eredője vonzó erőt eredményez.
- ↑ Mivel az O2 parciális nyomása () az O2 mólarányának () és a gázkeverék össznyomásának () a szorzata; a nagy parciális nyomást okozhatja az O2 magas részaránya a belélegzett gázban, vagy a belélegzett gáz nagy nyomása, esetleg a kettő kombinációja.
- ↑ A tűz pontos okát nem tudták egyértelműen azonosítani, de egyes bizonyítékok elektromos ívkisülésre (szikrára) utalnak.
Hivatkozások[szerkesztés]
- ↑ Current Table of Standard Atomic Weights in Order of Atomic Number. Commission on Isotopic Abundances and Atomic Weights – Commission II.I of the International Union of Pure and Applied Chemistry, 2013. (Hozzáférés: 2013. október 13.)
- ↑ Richard B. Stewart, Richard T. Jacobsen, W. Wagner (1991). „Thermodynamic Properties of Oxigen from the Triple Point to 300 K with Pesessures to 80 MPa”. J. Phys. Chem. Ref. Data 20 (5), 917-1021. o.
- ↑ Szõkefalvi-Nagy Zoltán; Szabadváry Ferenc: A magyar kémiai szaknyelv kialakulása. A kémia története Magyarországon. Akadémiai Kiadó, 1972. (Hozzáférés: 2010. december 3.)
- ↑ Russell L. Rasmussen – Joseph G. Morse – Karen W. Morse: Main Group Elements. In Inorganic Chemistry. Főszerk. Robert A. Meyers. 3. 25. o. = Encyclopedia of Physical Science and Technology, ISBN 978-0-12-227410-7
- ↑ WebElements Periodic Table of the Elements | Oxygen | Electronegativity. Webelements.com. (Hozzáférés: 2011. november 7.)
- ↑ a b Emsley 2001, p.297
- ↑ a b Oxygen. Los Alamos National Laboratory. [2007. október 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 16.)
- ↑ NASA (2007-09-27). "NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago". Sajtóközlemény. Elérés: 2008-03-13.
- ↑ a b c d e f g h i j Cook & Lauer 1968, p.500
- ↑ Barbara Herlihy. The Human Body in Health and Illness, 5th edition, Elsevier Health Sciences, 16. o.. 978-1-4557-7234-6 (2014. március 27.). Hozzáférés ideje: 2014. szeptember 5.
- ↑ Atomic oxygen erosion. [2007. június 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. augusztus 8.)
- ↑ a b c d Parks, G. D., Mellor, J. W.. Mellor's Modern Inorganic Chemistry, 6th, London: Longmans, Green and Co (1939)
- ↑ Molecular Orbital Theory. Purdue University. [2008. május 10-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. január 28.)
- ↑ Pauling, L.. The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, 3rd, Ithaca, N.Y.: Cornell University Press (1960). ISBN 0-8014-0333-2
- ↑ a b Jakubowski, Henry: Biochemistry Online. Saint John's University. (Hozzáférés: 2008. január 28.)
- ↑ a b c Emsley 2001, p.303
- ↑ Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet. University of Wisconsin-Madison Chemistry Department Demonstration lab. [2007. december 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 15.)
- ↑ Company literature of Oxygen analyzers (triplet). Servomex. [2008. március 8-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 15.)
- ↑ Krieger-Liszkay, Anja (2004. október 13.). „Singlet oxygen production in photosynthesis”. Journal of Experimental Botanics 56 (411), 337–46. o, Kiadó: Oxford Journals. DOI:10.1093/jxb/erh237. PMID 15310815.
- ↑ Harrison, Roy M.. Pollution: Causes, Effects & Control, 2nd, Cambridge: Royal Society of Chemistry (1990). ISBN 0-85186-283-7
- ↑ (2002. december 13.) „Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation”. Science 298 (5601), 2195–219. o. DOI:10.1126/science.1077642Jr.. PMID 12434011.
- ↑ Hirayama, Osamu, Nakamura, Kyoko; Hamada, Syoko; Kobayasi, Yoko (1994). „Singlet oxygen quenching ability of naturally occurring carotenoids”. Lipids 29 (2), 149–50. o, Kiadó: Springer. DOI:10.1007/BF02537155. PMID 8152349.
- ↑ Chieh, Chung: Bond Lengths and Energies. University of Waterloo. (Hozzáférés: 2007. december 16.)
- ↑ a b c Stwertka, Albert. Guide to the Elements, Revised, Oxford University Press, 48–49. o. (1998). ISBN 0-19-508083-1
- ↑ a b Cacace, Fulvio, de Petris, Giulia; Troiani, Anna (2001). „Experimental Detection of Tetraoxygen”. Angewandte Chemie International Edition 40 (21), 4062–65. o. DOI:<4062::AID-ANIE4062>3.0.CO;2-X 10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ↑ a b Ball, Phillip. „New form of oxygen found”, Nature News, 2001. szeptember 16. (Hozzáférés ideje: 2008. január 9.)
- ↑ Lundegaard, Lars F., Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge and Loubeyre, Paul (2006). „Observation of an O8 molecular lattice in the phase of solid oxygen”. Nature 443 (7108), 201–04. o. DOI:10.1038/nature05174. PMID 16971946.
- ↑ Desgreniers, S, Vohra, Y. K. & Ruoff, A. L. (1990). „Optical response of very high density solid oxygen to 132 GPa”. J. Phys. Chem. 94 (3), 1117–22. o. DOI:10.1021/j100366a020.
- ↑ Shimizu, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K. (1998). „Superconductivity in oxygen”. Nature 393 (6687), 767–69. o. DOI:10.1038/31656.
- ↑ a b c d e f Emsley 2001, p.299
- ↑ Air solubility in water. The Engineering Toolbox. (Hozzáférés: 2007. december 21.)
- ↑ Evans, David Hudson, Claiborne, James B.. The Physiology of Fishes. CRC Press, 88. o. (2006). ISBN 0-8493-2022-4
- ↑ Lide, David R.. Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements, CRC Handbook of Chemistry and Physics, 84th, Boca Raton, Florida: CRC Press (2003). ISBN 0-8493-0595-0
- ↑ Overview of Cryogenic Air Separation and Liquefier Systems. Universal Industrial Gases, Inc.. (Hozzáférés: 2007. december 15.)
- ↑ Liquid Oxygen Material Safety Data Sheet (PDF). Matheson Tri Gas. [2008. február 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 15.)
- ↑ a b c d Oxygen Nuclides / Isotopes. EnvironmentalChemistry.com. (Hozzáférés: 2007. december 17.)
- ↑ a b c Meyer, B.S. (2005. szeptember 20.). „Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen” (PDF) Workgroup on Oxygen in the Earliest Solar System. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. 9022. Hozzáférés: 2007. január 22..
- ↑ NUDAT 13O. (Hozzáférés: 2009. július 6.)
- ↑ NUDAT 14O. (Hozzáférés: 2009. július 6.)
- ↑ NUDAT 15O. (Hozzáférés: 2009. július 6.)
- ↑ Croswell, Ken. Alchemy of the Heavens. Anchor (1996. February). ISBN 0-385-47214-5
- ↑ a b c d Emsley 2001, p.298
- ↑ From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey however notes that according to later articles in Nature the values appear to be about 3% too high.
- ↑ a b c d e f g h Emsley 2001, p.301
- ↑ Fenical, William. Marine Plants: A Unique and Unexplored Resource, Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DIANE Publishing, 147. o. (1983. September). ISBN 1-4289-2397-7
- ↑ Walker, J. C. G.. The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag (1980)
- ↑ Brown, Theodore L., LeMay, Burslen. Chemistry: The Central Science. Prentice Hall/Pearson Education, 958. o. (2003). ISBN 0-13-048450-4
- ↑ a b Raven 2005, 115–27
- ↑ a b c d Derived from mmHg values using 0,133322 kPa/mmHg
- ↑ a b Normal Reference Range Table Archiválva 2011. december 25-i dátummal a Wayback Machine-ben from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ↑ a b The Medical Education Division of the Brookside Associates--> ABG (Arterial Blood Gas) Hozzáférés ideje: Dec 6, 2009
- ↑ Charles Henrickson. Chemistry. Cliffs Notes (2005). ISBN 0-7645-7419-1
- ↑ For humans, the normal volume is 6–8 liters per minute. [2012. szeptember 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. február 4.)
- ↑ Campbell, Neil A., Reece, Jane B.. Biology, 7th Edition. San Francisco: Pearson – Benjamin Cummings, 522–23. o. (2005). ISBN 0-8053-7171-0
- ↑ Freeman, Scott. Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall, 214, 586. o. (2005). ISBN 0-13-140941-7
- ↑ a b Berner, Robert A. (1999). „Atmospheric oxygen over Phanerozoic time”. Proceedings of the National Academy of Sciences of the USA 96 (20), 10955–57. o. DOI:10.1073/pnas.96.20.10955. PMID 10500106.
- ↑ (2009) „Oxygen, animals and oceanic ventilation: An alternative view”. Geobiology 7 (1), 1–7. o. DOI:10.1111/j.1472-4669.2009.00188.x. PMID 19200141.
- ↑ Dole, Malcolm (1965). „The Natural History of Oxygen” (PDF). The Journal of General Physiology 49 (1), 5–27. o. DOI:10.1085/jgp.49.1.5. PMID 5859927. (Hozzáférés ideje: 2007. december 16.)
- ↑ Jastrow, Joseph. Story of Human Error. Ayer Publishing, 171. o. (1936). ISBN 0-8369-0568-7
- ↑ a b c d e Cook & Lauer 1968, p.499.
- ↑ a b c Britannica contributors. John Mayow, Encyclopaedia Britannica, 11th (1911). Hozzáférés ideje: 2007. december 16.
- ↑ a b World of Chemistry contributors. John Mayow, World of Chemistry. Thomson Gale (2005). ISBN 0-669-32727-1. Hozzáférés ideje: 2007. december 16.
- ↑ Morris, Richard. The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press (2003). ISBN 0-309-08905-0
- ↑ a b c d e f g Emsley 2001, p.300
- ↑ "The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards."
- ↑ Priestley, Joseph (1775). „An Account of Further Discoveries in Air”. Philosophical Transactions 65, 384–94. o. DOI:10.1098/rstl.1775.0039.
- ↑ DeTurck, Dennis; Gladney, Larry and Pietrovito, Anthony: The Interactive Textbook of PFP96. University of Pennsylvania, 1997. [2008. január 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. január 28.)
- ↑ Roscoe, Henry Enfield, Schorlemmer, Carl. A Treatise on Chemistry. D. Appleton and Co., 38. o. (1883)
- ↑ a b Daintith, John. Biographical Encyclopedia of Scientists. CRC Press, 707. o. (1994). ISBN 0-7503-0287-9
- ↑ Poland.gov – Culture, Science and Media: Condensation of oxygen and nitrogen
- ↑ a b c How Products are Made contributors. Oxygen, How Products are Made. The Gale Group, Inc (2002). Hozzáférés ideje: 2007. december 16.
- ↑ Goddard-1926. NASA. [2015. november 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. november 18.)
- ↑ Non-Cryogenic Air Separation Processes. UIG Inc., 2003. (Hozzáférés: 2007. december 16.)
- ↑ Space Shuttle Use of Propellants and Fluids. National Aeronautics and Space Administration (2001. 09). Hozzáférés ideje: 2007. december 16. „NASAFacts FS-2001-09-015-KSC”
- ↑ a b Cook & Lauer 1968, p.510
- ↑ Sim MA, Dean P, Kinsella J, Black R, Carter R, Hughes M (2008). „Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated”. Anaesthesia 63 (9), 938–40. o. DOI:10.1111/j.1365-2044.2008.05536.x. PMID 18540928.
- ↑ Stephenson RN, Mackenzie I, Watt SJ, Ross JA (1996). „Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy”. Undersea Hyperb Med 23 (3), 185–8. o. PMID 8931286. (Hozzáférés ideje: 2008. szeptember 22.)
- ↑ Undersea and Hyperbaric Medical Society: Indications for hyperbaric oxygen therapy. [2011. május 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 22.)
- ↑ Undersea and Hyperbaric Medical Society: Carbon Monoxide. [2008. július 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 22.)
- ↑ Piantadosi CA (2004). „Carbon monoxide poisoning”. Undersea Hyperb Med 31 (1), 167–77. o. PMID 15233173. (Hozzáférés ideje: 2008. szeptember 22.)
- ↑ Hart GB, Strauss MB (1990). „Gas Gangrene – Clostridial Myonecrosis: A Review”. J. Hyperbaric Med 5 (2), 125–144. o. (Hozzáférés ideje: 2008. szeptember 22.)
- ↑ Zamboni WA, Riseman JA, Kucan JO (1990). „Management of Fournier's Gangrene and the role of Hyperbaric Oxygen”. J. Hyperbaric Med 5 (3), 177–186. o. (Hozzáférés ideje: 2008. szeptember 22.)
- ↑ Undersea and Hyperbaric Medical Society: Decompression Sickness or Illness and Arterial Gas Embolism. [2008. július 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 22.)
- ↑ Acott, C. (1999). „A brief history of diving and decompression illness”. South Pacific Underwater Medicine Society Journal 29 (2). ISSN 0813-1988. (Hozzáférés ideje: 2008. szeptember 22.)
- ↑ a b Morgenthaler GW, Fester DA, Cooley CG (1994). „As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations”. Acta Astronaut 32 (1), 39–49. o. DOI:10.1016/0094-5765(94)90146-5. PMID 11541018.
- ↑ Webb JT, Olson RM, Krutz RW, Dixon G, Barnicott PT (1989). „Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures”. Aviat Space Environ Med 60 (5), 415–21. o. PMID 2730484.
- ↑ a b c d Acott, C. (1999). „Oxygen toxicity: A brief history of oxygen in diving”. South Pacific Underwater Medicine Society Journal 29 (3). ISSN 0813-1988. (Hozzáférés ideje: 2008. szeptember 21.)
- ↑ Longphre, J. M. et al. (2007). „First aid normobaric oxygen for the treatment of recreational diving injuries”. Undersea Hyperb Med. 34 (1), 43–49. o. ISSN 1066-2936. PMID 17393938. (Hozzáférés ideje: 2008. szeptember 21.)
- ↑ a b Bren, Linda: Oxygen Bars: Is a Breath of Fresh Air Worth It?. FDA Consumer magazine. U.S. Food and Drug Administration, 2002. 12. [2007. október 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 23.)
- ↑ Ergogenic Aids. Peak Performance Online. [2007. szeptember 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. január 4.)
- ↑ George Goble's extended home page (mirror). [2009. február 11-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. február 4.)
- ↑ Cook & Lauer 1968, p.508
- ↑ a b Emsley 2001, p.304
- ↑ Hand, Eric (2008. március 13.). „The Solar System's first breath”. Nature 452 (7185), 259. o. DOI:10.1038/452259a. PMID 18354437. (Hozzáférés ideje: 2009. március 18.)
- ↑ Miller, J.R.; Berger, M.; Alonso, L.; Cerovic, Z.; Goulas, Y.; Jacquemoud, S.; Louis, J.; Mohammed, G.; Moya, I.; Pedros, R.; Moreno, J.F.; Verhoef, W.; Zarco-Tejada, P.J.. „Progress on the development of an integrated canopy fluorescence model”. Geoscience and Remote Sensing Symposium, 2003. IGARSS '03. Proceedings. 2003 IEEE International. Hozzáférés: 2008. január 22..
- ↑ Hans Breuer. Atlasz – Kémia, második, javított kiadás, Budapest: Athenaeum 2000 Kiadó, 171. o. (2000). ISBN 963 926124 6
- ↑ Maksyutenko, P., T. R. Rizzo, and O. V. Boyarkin (2006). „A direct measurement of the dissociation energy of water”. J. Chem. Phys. 125 (18), 181101. o. DOI:10.1063/1.2387163. PMID 17115729.
- ↑ Chaplin, Martin: Water Hydrogen Bonding, 2008. január 4. (Hozzáférés: 2008. január 6.)
- ↑ Smart, Lesley E.. Solid State Chemistry: An Introduction, 3rd, CRC Press, 214. o. (2005). ISBN 978-0-7487-7516-3
- ↑ a b Cook & Lauer 1968, p.507
- ↑ Crabtree, R.. The Organometallic Chemistry of the Transition Metals, 3rd, John Wiley & Sons, 152. o. (2001). ISBN 978-0-471-18423-2
- ↑ Cook & Lauer 1968, p.505
- ↑ Cook & Lauer 1968, p.506
- ↑ Dharmeshkumar N Patel, Ashish Goel, SB Agarwal, Praveenkumar Garg, Krishna K Lakhani (2003). „Oxygen Toxicity”. Indian Academy of Clinical Medicine 4 (3), 234. o.
- ↑ Cook & Lauer 1968, p.511
- ↑ Wade, Mark: Space Suits. Encyclopedia Astronautica, 2007. [2007. december 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 16.)
- ↑ a b Wilmshurst P (1998). „Diving and oxygen”. BMJ 317 (7164), 996–9. o. DOI:10.1136/bmj.317.7164.996. PMID 9765173.
- ↑ Donald, Kenneth. Oxygen and the Diver. England: SPA in conjunction with K. Donald (1992). ISBN 1-85421-176-5
- ↑ Donald K. W. (1947). „Oxygen Poisoning in Man: Part I”. Br Med J 1 (4506), 667–72. o. DOI:10.1136/bmj.1.4506.667. PMID 20248086.
- ↑ Donald K. W. (1947). „Oxygen Poisoning in Man: Part II”. Br Med J 1 (4507), 712–7. o. DOI:10.1136/bmj.1.4507.712. PMID 20248096.
- ↑ a b c d Werley, Barry L. (Edtr.) (1991). „Fire Hazards in Oxygen Systems”. ASTM Technical Professional training, Philadelphia: ASTM International Subcommittee G-4.05.
- ↑ (Report of Apollo 204 Review Board NASA Historical Reference Collection, NASA History Office, NASA HQ, Washington, DC)
- ↑ Chiles, James R.. Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. (2001). ISBN 0-06-662082-1
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Oxygen című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel.
Források[szerkesztés]
- dr. Boksay Zoltán, dr. Csákvári Béla, dr. Kónya Józsefné. Kémia III. Budapest: Nemzeti Tankönyvkiadó (1999). ISBN 963-19-5170-7
- Villány Attila. Kémia a kétszintű érettségire, második (javított kiadás), Budapest: Kemavill Bt. (2004). ISBN 963-212-130-9
- Kecskés, Kiss, Rozgonyi. Kémia 8. Budapest: Nemzeti Tankönyvkiadó (2006). ISBN 963-19-4250-3
További információk[szerkesztés]
- a magyar Wikipédia oxigént tartalmazó vegyületeinek listája külső keresővel
 A Wikimédia Commons tartalmaz Oxigén témájú kategóriát.
A Wikimédia Commons tartalmaz Oxigén témájú kategóriát.- Oxigén.lap.hu - linkgyűjtemény
Kapcsolódó szócikkek[szerkesztés]
|














![{\mathrm {C_{6}H_{{12}}O_{6}\ +6\ O_{2}\ \rightarrow \ 6\ CO_{2}+6\ H_{2}O}}+\ 2880\ \left[{\frac {kJ}{mol}}\right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce12f176cbf7526473f464b4a834ce05a8193333)












![{\mathrm {{\frac {1,8\ \left[{\frac {g}{min\cdot ember}}\right]\cdot 60\ \left[{\frac {min}{h}}\right]\cdot 24\ \left[{\frac {h}{nap}}\right]\cdot 365\ \left[{\frac {nap}{y}}\right]\cdot 6,6\cdot 10^{{9}}\left[ember\right]}{1\ 000\ 000\left[{\frac {g}{t}}\right]}}=6,24\cdot 10^{{9}}\left[t\right]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dcd4c84d65737c268c0a789de03ae40d0b1a406)



